
【题目】下列实验设计能够成功的是
A.除去粗盐中含有的硫酸钙杂质
![]()
B.检验亚硫酸钠试样是否变质
![]()
C.证明酸性条件H2O2的氧化性比I2强
![]()
D.检验某溶液中是否含有 Fe2+
![]()
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的原因的是
A. 铜久置空气中表面出现绿色固体:2Cu+O2+CO2+H2O═Cu2(OH)2CO3
B. 某种火箭发射阶段有少量N2O4,逸出,产生红色气体:N2O4![]() 2NO2
2NO2
C. FeSO4·7H2O在空气中久置变黄:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
D. SO2通入KMnO4溶液中,溶液紫色逐渐褪去:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4十2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100g浓度为ω%的稀硫酸中加入4g氧化铜粉末,待氧化铜全部溶解后,向所得蓝色溶液中加入10g铁粉,充分反应后,过滤,得滤液和4.8g滤渣.下列计算结果正确的是
A.4.8g滤渣是由3.2g铜和1.6g铁组成B.ω=14.7
C.反应过程中产生的氢气是2.24LD.滤液是20.88%的硫酸亚铁溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)212H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料 — 铝灰(含 Al、Al2O3 及少量 SiO2 和 FeOxFe2O3)可制备明矾。工艺流程如下:

回答下列问题:
(1)欲配制 480 ml 1.0 mol / L H2SO4 溶液,需要 18 mol / L H2SO4 溶液的体积是 _______,已有下列仪器:烧杯,量筒,胶头滴管,玻璃棒,还需用到的仪器是 _____________。
(2)“酸浸”过程中“,酸浸铁”发生反应的离子方程式是 ______________。
(3)明矾净水的原理是 _____________(用离子方程式表示)。
(4)检验滤液 A 中是否存在 Fe2+ 的实验操作是 __________________。
(5)在滤液 A 中加入高锰酸钾溶液的目的是 ________________(用离子方程式表示)(该条件下 MnO4- 转化为 Mn2+)
(6)已知:加入 MnSO4,Mn2+ 可与 MnO4- 反应生成 MnO2,该反应氧化剂与还原剂的物质的量之比为 ____________。
(7)操作Ⅱ是 ___________、__________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式正确的是
A. AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+
B. 碳酸的电离方程式:H2CO3![]() 2H++CO32-
2H++CO32-
C. 甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
D. 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molW气体和0.5molX气体混合于2L密闭容器中,使它们发生如下反应:4W(g)+3X(g) ![]() 2Y(g)+nZ(g)。2min末已生成0.2mol Y,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算
2Y(g)+nZ(g)。2min末已生成0.2mol Y,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时X的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.1mol物质均约含有6.02×1023个分子B.6.02×1023个氢分子就是1mol H2
C.1gH2与1mol H2所含分子数相等D.1mol H2O与1molH2SO4的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO用途广泛,对其进行研究具有重要的价值和意义
(1)2NO(g)+O2(g)=2NO2(g)△H=akJmol-1的反应历程与能量变化关系如图所示。已知:第Ⅱ步反应为:NO3(g)+NO(g)=2NO2(g)△H=bkJmol-1
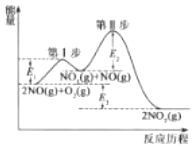
①第I步反应的热化学方程式为__。
②关于2NO(g)+O2(g)=2NO2(g)的反应历程,下列说法正确的是__。
A.相同条件下,决定该反应快慢的步骤为第Ⅱ步反应
B.使用合适的催化剂会使E1、E2、E3同时减小
C.第I步反应为吸热反应,第Ⅱ步反应为放热反应
D.反应的中同产物是NO3和NO
(2)NO的氢化还原反应为2NO(g)+2H2(g)N2(g)+2H2O(g)。研究表明:某温度时,v正=kcm(NO)cn(H2),其中k=2.5×103mol(m+n-1)L(m+n-1)s-1.该温度下,当c(H2)=4.0×10-3molL-1时,实验测得v正与c(NO)的关系如图一所示,则m=___,n=___。
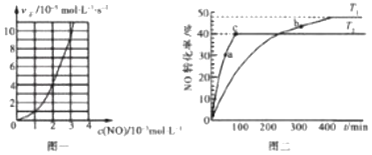
(3)NO易发生二聚反应2NO(g)N2O2(g)。在相同的刚性反应器中充入等量的NO,分别发生该反应。不同温度下,NO的转化率随时间(t)的变化关系如图二所示。
①该反应的△H___0(填“>”“<”或“=”)。
②T1温度下,欲提高NO的平衡转化率,可采取的措施为__(任写一条即可)。
③a、b处正反应速率va__vb(填”>”“<”或“=”),原因为___。
④e点对应体系的总压强为200kPa,则T2温度下,该反应的平衡常数kp=___kPa-1(Kp为以分压表示的平衡常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.24g镁与27g铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1mol重水与1mol水中,中子数比为2:1
D.1mol乙烷与1mol乙烯中,共价键数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com