
| A. | CaCO3 | B. | Na2SO3 | C. | H2SO4 | D. | Ca(OH)2 |
分析 新制氯水中存在平衡:Cl2+H2O?HCl+HClO,达到平衡后加入少量CaCO3(s),HCl与碳酸钙反应,而HClO不反应,溶液中氢离子浓度减小,平衡向正反应方向移动,HClO浓度增加,以此解答该题.
解答 解:新制氯水中存在平衡:Cl2+H2O?HCl+HClO,
A.因碳酸酸性比HClO强,比盐酸弱,加入少量CaCO3(s),HCl与碳酸钙反应,而HClO不反应,溶液中氢离子浓度减小,平衡向正反应方向移动,HClO浓度增加,故A正确;
B.加入Na2SO3,具有还原性,可与Cl2、HClO反应,次氯酸浓度降低,故B错误;
C.加入硫酸,氢离子浓度增大,平衡逆向移动,HClO浓度降低,故C错误;
D.加入Ca(OH)2,与HCl、HClO都反应,故D错误.
故选A.
点评 本题考查次氯酸的性质,为高频考点,侧重于学生的分析能力的考查,注意结合物质的性质从平衡移动的角度解答该题,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
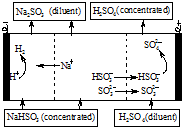 用NaOH溶液吸收SO2,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图,则下列说法不正确的是( )
用NaOH溶液吸收SO2,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图,则下列说法不正确的是( )| A. | 阳极区酸性增强 | |
| B. | diluent和concentrated的中文含义为浓缩的、稀释的 | |
| C. | 阴极区连接的是阳离子交换膜 | |
| D. | 该过程中的副产品主要为H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O | |
| B. | 碳酸氢钠溶液中加稀硫酸:CO32-+2H+=H2O+CO2↑ | |
| C. | 氢氧化钡溶液加入稀硫酸中:OH-+H+ H2O | |
| D. | Cu(OH)2加入H2SO4:2H++Cu(OH)2=Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
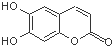 中草药秦皮中含有的七叶树内酯,具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
中草药秦皮中含有的七叶树内酯,具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )| A. | 2 mol Br2 2 mol NaOH | B. | 2 mol Br2 3 mol NaOH | ||
| C. | 3 mol Br2 4 mol NaOH | D. | 4 mol Br2 4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S+O2═2SO2;△H=-269kJ/mol(反应热) | |
| B. | 2NO2(g)═O2(g)+2NO(g);△H=+116.2kJ/mol(反应热) | |
| C. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0kJ/mol(燃烧热) | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 盐酸的物质的量浓度为1 mol•L-1,配制100 mL该溶液可用图3装置进行 | |
| B. | P点时反应恰好完全,溶液呈中性 | |
| C. | 曲线a是氢氧化钠溶液滴定盐酸的滴定曲线,可在图2的装置中进行 | |
| D. | 如果锥形瓶用待测液润洗,会使测定结果偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 | |
| B. | 常温下向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 常温下向水中加入少量固体CH3COONa,水的电离平衡逆向移动,c(H+)降低 | |
| D. | 常温下将水加热,Kw增大,pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com