
设 为阿伏伽德罗常数的值。下列说法正确的是
为阿伏伽德罗常数的值。下列说法正确的是
A.5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B.7.8gNa2S和Na2O2中含有的阴离子数大于0.1NA
C.50mL18.4mol/L浓硫酸与足量铜加热反应,生成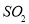 分子的数目为0.46NA
分子的数目为0.46NA
D.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA
D
【解析】SO2
试题分析:A.Fe和Cl2的物质的量都是0.1mol,发生反应时Cl2不足量,所以应该以氯气为标准碱性计算,转移电子数为0.2NA,错误;B . Na2S和Na2O2相对分子质量都是78,阳离子、阴离子个数比都是2:1,所以7.8gNa2S和Na2O2中含有的阴离子数等于0.1NA,错误;C。只有浓硫酸能够与Cu发生反应,当反应进行到一定程度,硫酸变为稀硫酸,这时反应就不再发生,因此50mL18.4mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目少于0.46NA,错误;D 在常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA ,正确。
考点:考查阿伏伽德罗常数的计算的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015届山东省高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是( )
选项 | Ⅰ | Ⅱ |
A | 将少量浓氨水滴入Al2(SO4)3溶液 | 将少量Al2(SO4)3溶液滴入浓氨水 |
B | 将少量SO2通入Ba(OH)2溶液 | 将过量量SO2通入Ba(OH)2溶液 |
C | 将0.1molCl2通入含有0.2molFeBr2的溶液中 | 将0.3molCl2通入含有0.2molFeBr2的溶液中 |
D | 将过量BaCl2溶液与少量Na2SO4溶液混合 | 将少量Ba(OH)2溶液与过量MgSO4溶液混合 |
查看答案和解析>>
科目:高中化学 来源:2015届山东省烟台市高三上学期期中考试化学试卷(解析版) 题型:选择题
某含Na+的溶液中,可能还存在NH4+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的一种或几种。进行以下实验:①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色溶液中加入BaCl2溶液时,无沉淀生成;③橙黄色溶液不能使淀粉变蓝。由此可以推知该溶液中肯定不存在的离子是
A.NH4+、Br-、CO32- B.NH4+、I-、SO32-
C.Fe2+、I-、SO32- D.Fe2+、CO32-、I-
查看答案和解析>>
科目:高中化学 来源:2015届山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:实验题
(16分)某兴趣小组利用以下装置制备氮化镁并探究氮化镁的某些性质。
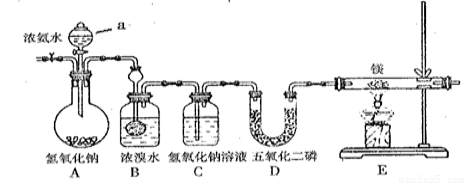
请完成横线上的相关问题:
(1)实验步骤及现象:
① 连接仪器并 。然后,向各仪器中加入适量所需药品。② 。
③ 打开分液漏斗活塞,观察到B中浓溴水颜色变浅至褪色,C中产生无色气泡。
④ 点燃酒精灯,观察到E中固体变成了黄绿色。(氮化镁是黄绿色固体,遇水剧烈反应生成两种碱)
(2)A装置中仪器a的名称为 。
(3)写出B处反应的化学方程式 。
(4)D装置中P2O5是一种非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
A.NH3 B. H2 C.SO2 D.CO2
(5)E装置中发生反应的化学方程式为 。
(6)此装置中存在着明显缺陷,你的改进措施是 。
(7)某同学要探究E中固体成分。将E中的固体放入稀盐酸中,观察到固体溶解并产生气泡,写出此过程中反应的化学方程式 、 。
查看答案和解析>>
科目:高中化学 来源:2015届山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列关于某溶液所含离子检验的方法和结论正确的是
A.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明有Ca2+
B.通入少量Cl2后,溶液变为黄色,再加入淀粉溶液后,溶液变蓝,说明有I-
C.加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中一定有CO32-或SO32-
D.往溶液中加入BaCl2溶液和稀HNO3,有白色沉淀生成,说明一定有SO42-
查看答案和解析>>
科目:高中化学 来源:2015届山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
化学与生活、社会密切相关。下列说法错误的是
A.亚硝酸盐属于实物防腐剂,可以适当地添加于食物中
B.氨气泄漏时,可喷洒大量的水以减少氨气的扩散
C.漂白粉在空气中不稳定,可用于漂白纸张
D.大量燃烧化石燃料是造成雾霾天气的重要原因
查看答案和解析>>
科目:高中化学 来源:2015届山东省潍坊市诸城高三10月月考化学试卷(解析版) 题型:选择题
根据表中信息判断,下列选项不正确的是

A.第①组反应中,H2O2作还原剂
B.第②组反应中, Cl2与FeBr2的物质的量之比为3:2
C.第③组反应中,每生成1molCl2转移电子2mol
D.从三个反应可以得出:氧化性由强到弱顺序为MnO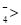 Fe3+>Cl2>Br2
Fe3+>Cl2>Br2
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三10月阶段性考试化学试卷(解析版) 题型:填空题
(每空1分,共6分)焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是 (写化学式)。
(2)写出并配平该反应的化学方程式: ;
(3)发生氧化反应的物质是 ,反应中4mol的氧化剂能 (填“失去”或“得到”) mol电子;
(4)反应中产生了11.2L(标准状况)的气体时,被还原的物质的质量为 。
查看答案和解析>>
科目:高中化学 来源:2015届山东省济宁市高三10月阶段测试化学试卷(解析版) 题型:选择题
北京2008奥运会金牌为金镶玉,直径为70mm,厚6mm。某化学兴趣小组对金牌中金属的成分提出猜想:甲认为该金属是由纯金制成;乙认为该金属是由金银合金制成;丙认为该金属是由黄铜(铜锌合金)制成。为了验证他们的猜想,取制造这种金牌的材质粉末少量进行实验,加入下面一种试剂来证明甲、乙、丙猜想的正误,该试剂应是( )
A.硫酸铜溶液 B.盐酸 C.稀硝酸 D.硝酸银溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com