
 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期及中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等:M 是地壳中含虽最多的金属元素.请用化学用语填空..
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期及中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等:M 是地壳中含虽最多的金属元素.请用化学用语填空..| J | ||||
| R |
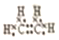 .
.| 选项 | A | B | C | D |
| M | 温度 | 温度 | H2的物质的量 | 甲的物质的量 |
| N | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物总物质的量 |
| 甲转化为HLO3的情况 | X取值范围 | N(HLO3)y/mol |
| 无HLO3的生成 | y=0 | |
| 有部分HLO3的生成 | ||
| 全部生成HLO3 |
分析 元素最低负化合价的绝对值与其原子最外层电子数相等,说明J的最低化合价与最高化合价绝对值相等,则J最外层电子数为4,根据J、R都为短周期元素可知J为C元素,则R应为S元素,M是地壳中含量最多的金属元素,故M为Al元素,而T是原子序数最大的元素,且为短周期主族元素,故T为Cl元素,由(4)题中L的最简单气态氢化物甲的水溶液显碱性,说明L为N元素,以此解答该题.
解答 解:(1)元素T为Cl,在周期表中的位置是第三周期、第ⅦA族,故答案为:第三周期、第ⅦA族;
(2)J和氢组成的化合物分子有6个原子,为乙烯,其电子式为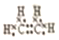 ,故答案为:
,故答案为: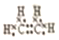 ;
;
(3)工业冶炼M的化学方程式为2Al2O3$\frac{\underline{\;\;\;通电\;\;\;}}{冰晶石}$4Al+3O2↑;M和R形成的化合物在潮湿的空气中迅速变质,反应化学方程式为Al2S3+6H2O=2Al(OH)3+3H2S↑,故答案为:2Al2O3$\frac{\underline{\;\;\;通电\;\;\;}}{冰晶石}$4Al+3O2↑;Al2S3+6H2O=2Al(OH)3+3H2S↑;
(4)①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的淸除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O(或2NH3+3H2O2=N2↑+6H2O),故答案为:2NH3•H2O+3H2O2=N2↑+8H2O(或2NH3+3H2O2=N2↑+6H2O);
②氨气分解为吸热反应,且体积增大,则
A.升高温度,平衡正向移动,氨气的物质的量减小,故A选;
B.为吸热反应,升高温度,K增大,故B不选;
C.H2的物质的量,平衡逆向移动,氨气的转化率减小,故C选;
D.氨气的物质的量增大,平衡正向移动,生成物的物质的量增大,故D不选;
故答案为:AC;
③氧气参加的反应有:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O; 4NO+3O2+2H2O=4HNO3,则
a.当氨气过量氧气不足量或氨气和氧气恰好反应时,根据方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O知,当0<x≤$\frac{5}{9}a$mol时,没有硝酸生成,所以y=0;
b.当氨气完全反应,氧气过量,过量的氧气恰好与一氧化氮反应时,x的取值范围为$\frac{5}{9}a$mol<x<$\frac{2}{3}$amol时,由4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O可知,与氨气反应消耗氧气的量为 $\frac{5a(1-x)}{4}$mol,剩余氧气的量$\frac{a(9x-5)}{4}$mol,由剩余氧气的量及4 NO+3 O2+2H2O=4 HNO3可知硝酸的物质的量为y=(3x-$\frac{5}{3}$ )amol,
c.当氧气与一氧化氮反应也过量时,即 $\frac{2}{3}$amol<x<1时,生成硝酸的物质的量为ymol,由4NH3+5O2$\frac{\underline{催化剂}}{△}$6H2O+4NO可知生成一氧化氮的物质的量为a(1-x) mol,氧气剩余,以一氧化氮的物质的量计算生成硝酸的量,则
4 NO+3 O2+2H2O=4 HNO3
4 4
a(1-x) mol ymol
y=a(1-x),
混合气体中O2为xmol.反应生成的HLO3为ymol,函数图象为 ,
,
故答案为:
| x的取值范围 | 用x表示的y值表达式 |
| 0<x≤$\frac{5}{9}a$mol | y=0 |
| $\frac{5}{9}a$mol<x<$\frac{2}{3}$amol | y=(3x-$\frac{5}{3}$)a |
| $\frac{2}{3}$amol<x≤1 | y=(1-x)a |
 .
.点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物知识推断元素为解答本题的关键,侧重分析与推断能力的考查,注意规律性知识的应用,选项(4)中计算为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | 苯(苯酚) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液与K3[Fe(CN)6]混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ | |
| B. | 向饱和食盐水中加入少量浓盐酸,看到溶液振荡,溶液变浑浊 | |
| C. | 某温度下,向AgCl饱和溶液中加入蒸馏水,AgCl的溶解度、Ksp均增大 | |
| D. | 处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 物品标签 |  |  |  |  |
| 分析 | 该试剂应装在橡 胶塞的细口瓶中 | 该药品不能与皮肤直接接触 | 受热易分解 | 该药品标签上还标有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3易溶于水,可用作净水剂 | |
| B. | 硅是半导体材料,纯净的硅是光纤制品的基本原料 | |
| C. | 浓硫酸能干燥氯气,说明浓硫酸具有吸水性 | |
| D. | 氨易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 0.6mol | C. | 0.8mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法判断该溶液中是否含有K+ | |
| B. | 该溶液中一定含有K+、SiO32-,可能含有CO32- | |
| C. | 该溶液中无SO32-,一定含有CO32- | |
| D. | 该溶液中可能含有K+和CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com