
(14分)以铬铁矿(主要成分为FeO和Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(红矾钠的主要成分为重铬酸钠:Na2Cr2O7·2H2O),其主要工艺流程如下:
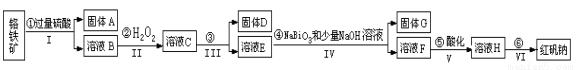
查阅资料得知:
i. 常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ii.
物质 | 开始沉淀的pH值 | 完全沉淀的pH值 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr (OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是 。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和__________(填仪器名称)。
(3)写出④反应的离子反应方程式 。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式 。
(5)将溶液H经过下列操作,蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
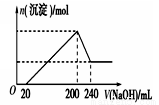
(6)取一定质量的固体D溶解于200mL的硫酸中,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则硫酸的浓度为 ,固体D中含Fe化合物的物质的量为 。
(14分)(每空2分)(1)增大反应物的接触面积,加快反应速率 (2)漏斗 烧杯
(3)3NaBiO3 + 2Cr3+ + 7OH-+ H2O=2CrO42- + 3Na+ + 3Bi(OH)3↓
(4)2CrO42-+2H+ 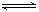 Cr2O72-+H2O (5)冷却结晶 (6)2.5 mol·L-1; 0.1mol
Cr2O72-+H2O (5)冷却结晶 (6)2.5 mol·L-1; 0.1mol
【解析】
试题分析:(1)矿石粉碎可以增大反应物的接触面积,加快反应速率。
(2)操作I、III、IV均是过滤,则用到的主要玻璃仪器有玻璃棒和漏斗、烧杯。
(3)常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-,则④反应的离子反应方程式为3NaBiO3 + 2Cr3+ + 7OH-+ H2O=2CrO42- + 3Na+ + 3Bi(OH)3↓。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,在转化过程中元素化合价不变,则该反应的离子方程式为2CrO42-+2H+ 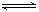 Cr2O72-+H2O。
Cr2O72-+H2O。
(5)从溶液中得到晶体的一般操作是蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠。
(6)根据图像可知加入氢氧化钠时没有立即产生沉淀,这说明酸过量,首先发生酸碱中和。当沉淀不再发生变化时需要氢氧化钠是180ml。继续加入氢氧化钠沉淀开始减小,即氢氧化铝开始溶解,溶解氢氧化铝消耗的氢氧化钠溶液是40mol,则生成氢氧化铝消耗的氢氧化钠溶液体积是120ml,所以与铁离子反应的氢氧化钠溶液体积是60ml,物质的量是0.06mol/L×5mol/L=0.3mol,所以根据方程式Fe3++3OH—=Fe(OH)3↓,所以铁离子是0.1mol。沉淀达到最大值时溶液中的溶质是硫酸钠,则根据原子守恒可知硫酸钠的物质的量是0.2L×5mol/L/2=0.5mol,则硫酸的浓度是0.5mol÷0.2/L=2.5mol/L。
考点:考查物质制备工艺流程图的分析与应用


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015北京市昌平区高一上学期期末考试化学试卷(解析版) 题型:选择题
对于NH3不能用浓H2SO4干燥的原因分析正确的是
A.浓硫酸有强氧化性
B.NH3极易溶于水
C.NH3具有碱性物质的性质
D.两者会发生反应生成沉淀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市黄浦区高三上学期期末调研测试化学试卷(解析版) 题型:选择题
下列反应中,浓硫酸既表现出强氧化性又表现出酸性的是
A.2NaCl+H2SO4(浓) Na2SO4+2HCl↑
Na2SO4+2HCl↑
B.Na2SO3+H2SO4(浓) Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
C.C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
D.2FeO+4H2SO4(浓) Fe2(SO4)3+SO2↑+4H2O
Fe2(SO4)3+SO2↑+4H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高高三第二次月考理综化学试卷(解析版) 题型:选择题
下列叙述错误的是
A.Al2(SO4)3可除去酸性废水中的悬浮颗粒
B.氯气与石灰乳反应能得到含氯漂白剂
C.燃煤时加入适量石灰石,可减少废气中SO2的排放
D.工业上硝酸可用于制化肥、炸药和染料等
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省资阳市高三第二次诊断性考试理综化学试卷(解析版) 题型:选择题
下列离子方程式或化学方程式与所述事实相符且正确的是
A.硫酸与氢氧化钡反应的中和热化学反应方程式为: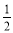 H2SO4(aq)+
H2SO4(aq)+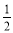 Ba(OH)2(aq)=
Ba(OH)2(aq)=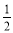 BaSO4(s)+H2O(l) ΔH=-57.3 kJ/mol
BaSO4(s)+H2O(l) ΔH=-57.3 kJ/mol
B.向0.1 mol·L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH- = H2O
C.以金属银为阳极电解饱和硫酸铜溶液:2Cu2++2H2O 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-= AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省眉山市高三第一次诊断性考试理综化学试卷(解析版) 题型:选择题
下列溶液或浊液中,关于离子浓度的说法正确的是
A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小
B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-) > c(HCO3-),且2c(Na+)=3[c(CO32-)+c(HCO3-)]
C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:c(CH3COO-) + 2c(OH-) = c(CH3COOH) + 2c(H+)
D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:填空题
(共12分)
醛类是重要的有机物。
47.松柏醇臭氧化反应生成的B含有醛基。

写出结构简式:B ;A 。
48.已知:
②醛甲+醛乙 醇+羧酸(歧化反应,简单的醛被氧化)
醇+羧酸(歧化反应,简单的醛被氧化)
醛基旁边的碳原子上的H原子叫α-H原子,比较活泼。制备季戊四醇的反应“流程”如下:

(1)写结构简式:D ;季戊四醇 。
(2)月桂酸季戊四醇酯[C12H25COOCH2C(CH2OH)3]是一种优良的中性洗涤剂, 试简述其可做洗涤剂的结构原因 。
(3)实际生产中甲醛过量,原因是 。
49.酯交换反应是指:酯+醇(酚)→新酯+新醇(酚)。松柏醇的一种芳香族同分异构体有以下特点:
①有邻位的2个取代基;②遇氯化铁溶液呈紫色;③发生分子内的酯交换反应,生成有六元环的内酯和甲醇,则该内酯的结构简式为 。
50.环己酮中α-H也比较活泼,能发生以下反应:
 则E的结构简式为 。
则E的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:选择题
分子式为C5H12O的有机物共有8种属于醇类的同分异构体,其中含有-CH2OH基团的有
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三12月月考理综化学试卷(解析版) 题型:填空题
(12分)【化学——有机化学基础】
“心得安”是治疗心脏病的药物,下面是它的一种合成路线(具体反应条件和部分试剂略):
回答下列问题:
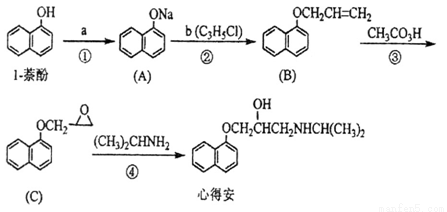
(1)试剂a是_________________。
(2)③的反应类型是___________________。
(3)试剂b可由丙烷经三步反应合成:
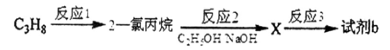
反应1的试剂与条件__________________;
反应2的化学方程式为_______________________________________________;
反应3的反应方程式为_______________________________________________。
(4)芳香化合物D(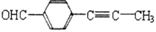 )_________(填 是或不是)1-萘酚的同分异构体
)_________(填 是或不是)1-萘酚的同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com