
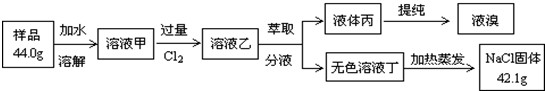
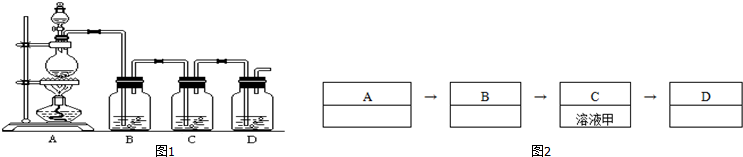
分析 (1)氯气的制取选用二氧化锰和浓盐酸,饱和食盐水除去氯化氢,通气体选用C装置,过量的氯气用氢氧化钠除去;
(2)萃取实验的主要玻璃仪器是分液漏斗;
(3)溶液甲为混有溴化钠的氯化钠溶液,通入氯气后,氯气可以置换出溴化钠中的溴;
(4)根据反应前后固体质量差,结合反应方程式用差量法进行计算.
解答 解:(1)氯气的制取选用二氧化锰和浓盐酸,故A装置中所放的化学药品为二氧化锰和浓盐酸,用饱和食盐水除去氯化氢,故B装置中所放的化学药品为饱和食盐水,反应中过量的氯气用氢氧化钠除去,所以D装置中的试剂为氢氧化钠溶液,
故答案为:二氧化锰和浓盐酸;饱和食盐水;氢氧化钠溶液;
(2)萃取实验的主要玻璃仪器是分液漏斗,
故答案为:分液漏斗;
(3)溶液甲为混有溴化钠的氯化钠溶液,通入氯气后,氯气可以置换出溴化钠中的溴,反应的化学方程式为2NaBr+Cl2=2NaCl+Br2,
故答案为:2NaBr+Cl2=2NaCl+Br2;
(4)设样品中溴化钠的质量为xg,2NaBr+Cl2=2NaCl+Br2 △m
206 117 89
x 44-42.1=1.9
$\frac{206}{x}$=$\frac{89}{1.9}$,x=4.4,故原固体混合物中氯化钠的质量分数为:$\frac{44.0-4.4}{44.0}$×100%=90.0%,
故答案为:90.0%.
点评 本题是关于食盐样品的纯度的综合题,对学生分析和解决问题的能力要求较高,难度较大,注意用差量法进行计算.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
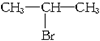 (主要产物),1mol某烃A充分燃烧后得到8mol CO2和4mol H2O.
(主要产物),1mol某烃A充分燃烧后得到8mol CO2和4mol H2O.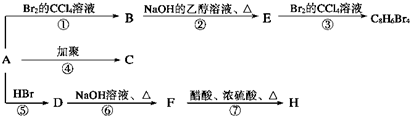
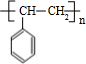
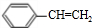 .
.
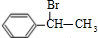 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$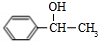 +NaBr
+NaBr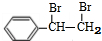 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$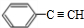 +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
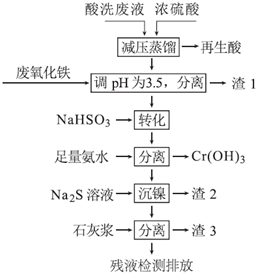
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若3<m<8,则X必定为主族元素 | |
| B. | 若a<b且m=n=4,X、Y不可能形成化合物 | |
| C. | Y的气态氢化物的分子式为H8-nY | |
| D. | 若a=b=3,8>m>n>5,则元素非金属性:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | O-O | O=O | C-0 | C=O | H-O |
| 能量(KJ) | 415 | 138 | 498 | 343 | 798 | 465 |
| A. | 放出热量800kJ | B. | 放出热量1520kJ | C. | 吸收热量410kJ | D. | 放出热量610kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu→CuCl2 | B. | CuO→Cu2O | C. | Cu(OH)2→CuO | D. | CuO→Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a、b、c的简单离子中,b的离子半径最大 | |
| B. | c、d、f最高价氧化物对应的水化物两两之间均可发生反应 | |
| C. | e的氢化物比f的氢化物的稳定性高 | |
| D. | 离子半径a3-小于d3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2 | B. | COCl2 | C. | C2H6O | D. | H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 预期现象和结论 | |
| ① | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再将产生的气体经蒸馏水、四氯化碳后导入澄清石灰水中 | a.若澄清石灰水未见浑浊,则假设1成立 b.若澄清石灰水变浑浊,则假设2或3成立 |
| ② | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再向试管中滴入1-2滴品红溶液,振荡 | 若品红褪色,结合实验①中的现象和结论b,则假设3 成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com