
| A����ƽ��ʱ���ס�����������A�����ʵ�������ȣ���x=3 |
| B��ƽ��ʱ���ס�����������A��B�����ʵ���֮�Ȳ���� |
| C��ƽ��ʱ����A���������Ϊ40% |
| D����ƽ��ʱ�������е�ѹǿ����ȣ�����������ѹǿ֮��Ϊ8��5 |
 xC��g��+D��s��
xC��g��+D��s�� 

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
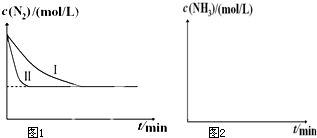 ��1����֪��N2��g��+O2��g���T2NO��g����H1
��1����֪��N2��g��+O2��g���T2NO��g����H1| �¶�/�� | ��ʼ��/mol | ƽ����/mol[ѧ�� | �ﵽƽ���� ��ʱ��/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
| һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��n��A��=n��C�� |
| B��n��B��=n��C�� |
| C��n��A��+n��B��=n��C�� |
| D��n��B��+n��C��=n��A�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 4 |
| 5 |
| A��50% | B��37.5% |
| C��25% | D��12.5% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
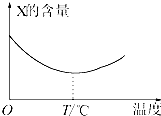 ������̬����X��Y��ֱ�ӻ�������Z�����淴Ӧ�����罫X��Y��һ��������ϲ�ѹ���ܱ������У��ڲ�ͬ�¶��¾���һ��ʱ���Ӧ�������X�ĺ����仯��ͼ��ʾ���ش��������⣺
������̬����X��Y��ֱ�ӻ�������Z�����淴Ӧ�����罫X��Y��һ��������ϲ�ѹ���ܱ������У��ڲ�ͬ�¶��¾���һ��ʱ���Ӧ�������X�ĺ����仯��ͼ��ʾ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������¶� |
| B�����ú�����������ͭ��п |
| C������98%��Ũ���� |
| D����ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij��ʳƷ�����ϱ�ǩ��ͼ��ʾ��
ij��ʳƷ�����ϱ�ǩ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
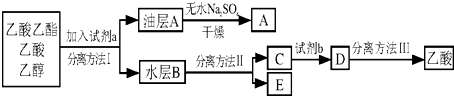
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ʵ���Ũ����ȵĴ�����Һ������������Һ�������ϣ�c��Na+��+c��H+��=c��CH3COO-��+c��OH-��+c��CH3COOH�� |
| B��0.2mol/L NH4NO3��0.1 mol/L NaOH��Һ�������Ϻ�c��NH4+����c��NO3-����c��Na+����c��OH-����c��H+�� |
| C�������£�ͬŨ�ȵ�һԪ��HA��HB���룬����ͬŨ�ȵ�NaA��Һ��NaB��Һ��pH�� |
| D��ͬŨ�ȵ�������Һ����NH4Al��SO4��2����NH4Cl����NH3?H2O����CH3COONH4������c��NH4+���ɴ�С��˳���ǣ��٣��ڣ��ܣ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com