
| 容器编号 | 温度 | 起始时各物质的物质的量/mol | 达到平衡时体系能量的变化 | 达到平衡所需时间 | |
| N2O4 | NO2 | ||||
| ① | T1 | 2 | 0 | 吸热22.8kJ | 2min |
| ② | T2 | 0 | 4 | 放热Q(Q>0)kJ | … |
| ③ | T3 | 3 | 1 | … | … |
| A. | 容器①中,从起始到平衡时,用NO2表示的平均反应速率v(NO2)为0.2mol(L•min) | |
| B. | 若容器①在恒温恒压下达平衡,该条件下的平衡常数等于0.2 | |
| C. | 若Q<34.2kJ,则T1>T2 | |
| D. | 容器③在达平衡前,v(正)<v(逆) |
分析 A.生成的二氧化氮为2×$\frac{22.8kJ}{57kJ/mol}$=0.8mol,再根据v=$\frac{△c}{△t}$计算;
B.生成的二氧化氮为0.8mol,则:
N2O4(g)?2NO2(g)
开始(mol):2 0
转化(mol):0.4 0.8
平衡(mol):1.6 0.8
恒温恒压下,平衡时体积为2L×$\frac{(1.6+0.8)mol}{2mol}$=2.4L,再计算平衡浓度,代入平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$计算;
C.若①②温度相同,二者为等效平衡,平衡时N2O4为1.6mol,若Q<34.2kJ,则②中生成N2O4小于$\frac{34.2kJ}{57kJ/mol}$=0.7mol,与①相比平衡正向移动;
D.容器③中不能确定反应进行方向.
解答 解:A.生成的二氧化氮为2×$\frac{22.8kJ}{57kJ/mol}$=0.8mol,则v(NO2)=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol(L•min),故A正确;
B.生成的二氧化氮为0.8mol,则:
N2O4(g)?2NO2(g)
开始(mol):2 0
转化(mol):0.4 0.8
平衡(mol):1.6 0.8
恒温恒压下,平衡时体积为2L×$\frac{(1.6+0.8)mol}{2mol}$=2.4L,则平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$=$\frac{(\frac{0.8}{2.4})^{2}}{\frac{1.6}{2.4}}$=$\frac{1}{6}$,故B错误;
C.若①②温度相同,二者为等效平衡,平衡时N2O4为1.6mol,若Q<34.2kJ,则②中生成N2O4小于$\frac{34.2kJ}{57kJ/mol}$=0.7mol,与①相比平衡正向移动,正反应为吸热反应,升高温度平衡正向移动,则T1<T2,故C错误;
D.容器③中不能确定反应进行方向,则在达平衡前v(正)、v(逆)相对大小不能确定,故D错误,
故选:A.
点评 本题考查化学平衡计算及影响因素,B选项为易错点,注意容器的体积发生变化,C中注意利用等效平衡进行分析解答,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).下列分析正确的是( )
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).下列分析正确的是( )| A. | OE段表示的平均速率最快 | |
| B. | EF段,用盐酸表示该反应的平均反应速率为0.6mol/(L•min) | |
| C. | OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7 | |
| D. | G点表示收集的CO2的量最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;元素C在周期表中的位置是第二周期第VA族,A与B所形成的化合物BA4的电子式为
;元素C在周期表中的位置是第二周期第VA族,A与B所形成的化合物BA4的电子式为 ;
;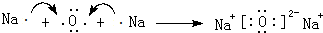 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定形成共价键 | B. | 可能是共价键,也可能是离子键 | ||
| C. | 一定是离子键 | D. | 以上说法都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向磁性氧化铁溶解于足量稀盐酸后的溶液中滴加酸性KMnO4溶液,紫红色消失,表明溶液中含有Fe2+ | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | FeCl3、FeCl2、Fe(OH)3三种化合物都可以通过化合反应制得 | |
| D. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①③ | B. | ③④ | C. | 全部 | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com