
| A. | 至少存在5种离子 | |
| B. | SO42-、NH4+、一定存在,Cl-可能不存在 | |
| C. | Cl-一定存在,且c(Cl?)≥0.4mol/L | |
| D. | CO32-、Al3+一定不存在,K+可能存在 |
分析 加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵根离子,红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,一定没有CO32-;
4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,物质的量为$\frac{4.66g}{233g/mol}$=0.02mol,根据以上数据推算存在离子,根据电荷守恒推算氯离子的存在及数据.
解答 解:加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵根离子,红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,一定没有CO32-;
4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,物质的量为$\frac{4.66g}{233g/mol}$=0.02mol,
A.由上述分析可知,一定含SO42-、NH4+、Fe3+,溶液中NH4+、Fe3+所带正电荷为0.02mol+3×0.02mol=0.08mol,SO42-所带负电荷为2×0.02mol=0.04mol,
据电荷守恒,知溶液中必然大量存在另一种阴离子Cl-,至少存在4种离子,故A错误;
B.由上述分析可知,Cl-、SO42-、NH4+一定存在,故B错误;
C.由电荷守恒可知,Cl-一定存在,且c(Cl-)≥0.4mol/L,故C正确;
D.综上所述,原溶液中一定含Fe3+、NH4+、SO42-和Cl-,可能含Al3+、K+,一定不含CO32-,故D错误;
故选C.
点评 本题考查物质的检验及推断,为高考常见题型和高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意常见离子的性质和反应类型的判断,答题时认真阅读、分析题中数据,合理分析,特别是氯离子的推断,注意电荷守恒的应用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | 肥皂 | C. | C17H35COONa | D. | 高级脂肪酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “若水银已升朱”指的是水银气化,属于物理变化 | |
| B. | 朱砂、水银、银朱中均含汞元素,其组成、结构或纯度有所不同 | |
| C. | 常温下,朱砂转化为水银是不自发的过程 | |
| D. | 工业废水中含有汞离子,可以加入FeS固体除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | Y | |
| Z |
| A. | 非金属性:Z>Y | |
| B. | 原子的半径:W<X | |
| C. | Z的氧化物能与Y的氢化物反应生成强酸 | |
| D. | Z一种单质熔点为119℃,易溶于二硫化碳,则该单质属于原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素中,甲的最高价氧化物对应水化物的酸性最强 | |
| B. | 四种元素中,丙的气态氢化物最稳定 | |
| C. | 乙在自然界中形成的化合物种类最多 | |
| D. | 丁和甲、乙、丙都只能形成一种共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| B. | 漂白粉和二氧化硫均具有漂白性,将两者混合使用,可增强漂白效果 | |
| C. | 酒精能使蛋白质变性,医院一般用100%的酒精进行消毒 | |
| D. | 氧化铝熔点很高,其制造的坩埚可用于熔融烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
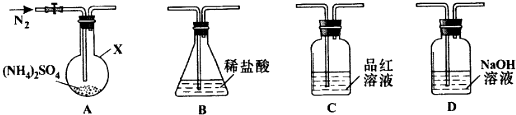
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1 L0.1mol•L-1的硝酸铵溶液中氮原子数目为0.2NA | |
| B. | 标准状况下,6.0gNO和2.24LO2混合,所得气体的分子数目为0.2NA | |
| C. | 1 mol有机物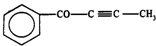 中最多有6 NA个原子在一条直线上 中最多有6 NA个原子在一条直线上 | |
| D. | 1 mol甲基(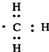 )所含的电子数为7 NA )所含的电子数为7 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com