
向一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入250mL 4mol/L的稀硝酸,恰好使混合物完全溶解.放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现,若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为( )
|
| A. | 0.21mol | B. | 0.25mol | C. | 0.45mol | D. | 0.5mol |
| 有关混合物反应的计算. | |
| 分析: | 混合物与硝酸反应时恰好使混合物完全溶解,且所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为Fe(NO3)2.足量的氢气在加热下还原相同质量的混合物,由铁元素守恒可知,能得到铁的物质的量与Fe(NO3)2中的铁的物质的量相同,根据氮元素守恒计算n[Fe(NO3)2],再根据Fe元素守恒计算氢气还原混合物得到Fe的物质的量. |
| 解答: | 解:因一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入250mL 4mol/L的稀硝酸,恰好使混合物完全溶解,无血红色出现,说明溶液中的溶质为Fe(NO3)2, 根据氮元素守恒,硝酸亚铁中的硝酸根离子的物质的量为0.25L×4mol/L﹣ 故选C. |
| 点评: | 本题考查混合物计算,难度中等,侧重考查学生利用原子守恒的方法来计算,明确硝酸亚铁与硝酸的关系,硝酸亚铁中铁元素与原混合物中的铁元素的关系是解答的关键. |


科目:高中化学 来源: 题型:
下列图示的四种实验操作名称从左到右依次是
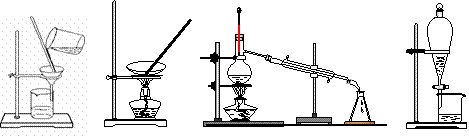

A.过滤、蒸发、蒸馏、分液 B.过滤、蒸馏、蒸发、分液
C.蒸发、蒸馏、过滤、分液 D.分液、蒸馏、蒸发、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D四种短周期元素,它们之间的关系如下:
Ⅰ.原子半径:A < C < B < D Ⅱ.原子的最外层电子数:A + C = B + D = 8
Ⅲ.原子的核外电子层数:B = C = 2A Ⅳ.B元素的主要化合价:最高正价 + 最低负价 = 2
请回答:
(1)由A、B两种元素组成的常见气体,其电子式为 ;只有A和B两种元素组成的属于离子晶体的化合物可能为 (用化学式表示)。
(2)由D元素形成的氢氧化物,与强碱溶液反应的离子方程式为 。
(3)由B、C元素组成的化合物BC3,该化合物具有强氧化性,与水反应生成两种酸和一种无色气体,该气体常温下遇空气变红棕色,写出该化合物与水反应的化学方程式 。
(4)由A、B和C三种元素组成的盐,常温下其水溶液显酸性,写出检验该盐中所含阳离子的实验方法 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是( )
|
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl﹣、S2﹣ |
|
| B. | 酸性溶液中可能大量存在Na+、ClO﹣、SO42﹣、I﹣ |
|
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl﹣、HCO3﹣ |
|
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl﹣、SO42﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
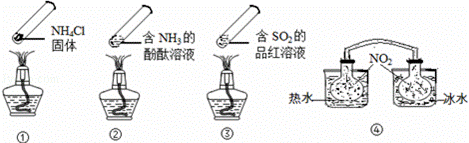
|
| A. | 加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
|
| B. | 加热时,②、③溶液均变红,冷却后又都变为无色 |
|
| C. | ④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
|
| D. | 四个“封管实验”中所发生的化学反应都是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应在生产、生话中应用广泛,用所学知识回答问题:
(1)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2,该反应的化学方程式为 ,反应中消耗1mol的H2C2O4时转移电子数为
(2)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol
(3)写出Na2S与FeCl3溶液混合的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有机物A由C、H、O三种元素组成,取1 mol 充分燃烧生成4 mol CO2 和54 g H2O,A 的相对分子质量为86。回答下列问题:
(1)A物质的分子式是 。
(2)A物质符合下列条件:
① 能与Br2的CCl4溶液发生化学反应使其褪色;② 能与NaHCO3溶液反应放出CO2气体;
符合上述要求的A有多种,其结构简式分别是 。
(不要求顺反异构与立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A. | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B. | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D. | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com