解答:解:(1)根据质量守恒定律及反应方程式知,该反应反应前后气体的物质的量不变,气体的质量变小,所以平均摩尔质量减小,温度升高,平衡时混合气体的平均相对摩尔质量减小,说明平衡向正反应方向移动,所以正反应是吸热反应,
故答案为:吸热;
(2)A.反应前后气体的物质的量不变,所以不能用压强判断平衡,故A错误;
B.反应前后气体体积不变,气体的质量减少,所以密度减小,所以容器内气体密度不再发生变化即是平衡状态,故B正确;
C.随着反应进行,C分子逐渐增多,所以容器内气体C的分子总数不再发生变化即是平衡状态,故C正确;
D.相同时间内消耗2nmolA的同时消耗nmolB,都是向正方向进行,所以不能判断平衡状态,故D错误;
E.相同时间内生成2nmolA为正反应,同时生成3nmolC为逆反应,而且反应的比值等于计量数之比,所以能判断平衡,故E正确;
故答案为:BCE;
(3)根据等效平衡,把物质都换算成方程式一边的物质,且和初始加入的入2mol A和1mol B相等即可.
①4mol A+2mol B 与初始A、B浓度不同,故错误;
②3molC+l mol D+1mol B换算成A、B,A、B浓度分别为2mol、2mol,与初始浓度不同,故错误;
③3mol C+2mol D 换算成A、B,A、B浓度分别为2mol、1mol,D是固体,对气体无影响,故正确;
④1.6molA+0.8 mol B+0.6mol C 与初始浓度相比,增大了C,平衡逆移,但是C的浓度增大,故错误;
⑤2mol A+1mol B+1molHe,体积恒定,加入稀有气体,平衡不移动,所以加入1molHe无影响,A、B浓度分别为2mol、1mol与初始浓度相同,故正确;
故答案为:③⑤;
(4)2A(g)+B(g)
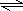
3C(g)+D(S),
C、D未反应 0 0 3mol 0.8 mol
D完全反应 1.6mol 0.8 mol 0.6mol 0
CD未反应时容器的体积V=
=
=2.5L;
D完全反应时容器的体积V=
=
=0.5L;
即体积为0.5L<V<2.5L,故答案为:0.5;2.5.

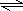 3C(g)+D(S),
3C(g)+D(S),
