
活性炭可用于处理大气污染物NO。在1 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当
温度分别在T1 ℃和T2 ℃时,测得平衡时各物质的物质的量如下表:
|
T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
(1)请结合上表数据,写出NO与活性炭反应的化学方程式:__________________。
(2)上述反应在T1 ℃时的平衡常数为K1,在T2 ℃时的平衡常数为K2。
①计算K1=__________________。
②根据上述信息判断,T1和T2的关系是__________。
a.T1>T2 b.T1<T2 c.无法比较
(3)在T1 ℃下反应达到平衡后,下列措施不能改变NO的转化率的是________(填序号)。
a.增大c(NO) b.增大压强
c.升高温度 d.移去部分F
科目:高中化学 来源: 题型:
已知:4NH3+5O2 4NO+6H2O,4NO+3O2+2H2O→4HNO3
4NO+6H2O,4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80.
(1)a mol NO完全转化为HNO3理论上需要氧气 mol.
(2)为使NH3恰好完全氧化为NO,氨﹣空气混合气体中氨的体积分数(用小数表示)为 (保留2位小数).
(3)20.0mol NH3用空气氧化,产生混合物的组成为:NO 18.0mol、O2 12.0mol、N2 150.0mol和一定量硝酸,以及其他成分(高温下NO与O2不化合).计算氨转化为NO和HNO3的总转化率.
(4)20.0mol NH3和一定量空气充分反应后,再转化为硝酸.通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线.
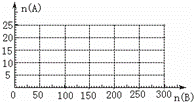
查看答案和解析>>
科目:高中化学 来源: 题型:
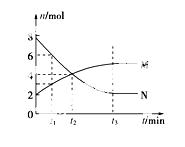 在一定温度下,容器内某一反应中,M、N的物质的量随反应时间变化的曲线如下图,下列表述正确的是( )
在一定温度下,容器内某一反应中,M、N的物质的量随反应时间变化的曲线如下图,下列表述正确的是( )
A.反应的化学方程式为2M N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为
2NH3(g)+NO(g)+NO2(g)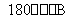 2N2(g)+3H2O(g) ΔH<0
2N2(g)+3H2O(g) ΔH<0
在恒容的密闭容器中,下列有关说法正确的是 ( )
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:4NH3(g)+5O2(g)===4NO(g)+6H2O(g);ΔH=-1 025 kJ/mol,该反应是一个
可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
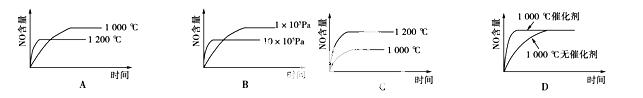
查看答案和解析>>
科目:高中化学 来源: 题型:
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是 ( )
A.上述生成Ni(CO)4的反应为放热反应
B.25 ℃时反应Ni(CO)4(g)  Ni(s)+4CO(g)的平衡常数为2×10
Ni(s)+4CO(g)的平衡常数为2×10 -5
-5
C.在80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时v正>v逆
D.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)
 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
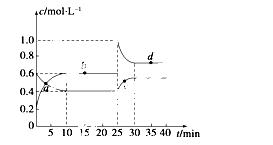
(1)该温度下,该反应的平衡常数为______________,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为____________。
(3)25 min时,加入了__________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度________(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气净化中的一个反应如
下:
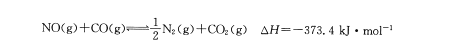
在一容积为5L的恒容密闭容器中充人0.2 mol NO和0.5mol CO,5 min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是
min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是
A.达到平衡后,若只升高温度,化学平衡正向移动
B.达到平衡后,再通人稀有气体,逆反应速率增大
C.使用催化剂,平衡常数不变
D.0~5 min内,NO的反应速率为2.4×1 0-3 mol·L一1·min一1
查看答案和解析>>
科目:高中化学 来源: 题型:
小明同学在学习“硫酸及其盐的某些性质与用途”的过程中,进行如下实验探究。
[实验一]探究浓硫酸的氧化性,将实验室常用的药品放入如图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
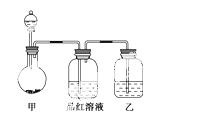
(1)该装置设计上存在明显缺陷,请指出:_______________________________。
(2)写出装置甲中反应的化学方程式:______________________________
__________________。装置乙中的试剂是:_______________________。
[实验二]探究某硫酸亚铁盐固体是否变质
(3)请你帮助小明同学完成如下实验方案:
| 实验操作 | 预期现象和结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com