
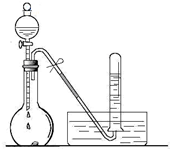
 某校化学实验小组同学进行有关NO2气体的系列实验.
某校化学实验小组同学进行有关NO2气体的系列实验.| a |
| 64 |
| a |
| 32 |
| a |
| 32 |
| a |
| 32 |


科目:高中化学 来源: 题型:
| A、M>N>P>Q |
| B、P>M>N>Q |
| C、N>Q>P>M |
| D、M>P>Q>N |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
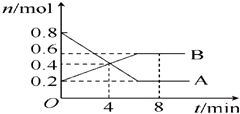
查看答案和解析>>
科目:高中化学 来源: 题型:
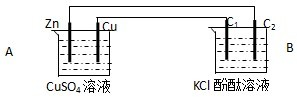
查看答案和解析>>
科目:高中化学 来源: 题型:
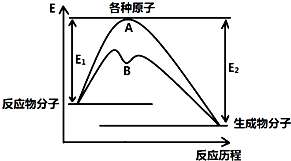 已知某反应在不同条件下的反应历程可以表示成如图所示,E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题:
已知某反应在不同条件下的反应历程可以表示成如图所示,E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题:| 化学键 | H-H | Cl-Cl | O=O | O-H | H-Cl |
| 键能(kJ?mol-1) | 436 | 247 | x | 463 | 431 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com