
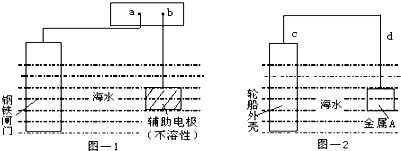
| A、图-1:a为电源正极 |
| B、图-1:辅助电极上发生氧化反应 |
| C、图-2:电流方向d→c |
| D、图-2:金属A可以是耐腐蚀的金属铜 |


科目:高中化学 来源: 题型:
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 取少量试液于试管中,加入用HNO3酸化的BaCl2溶液,产生白色沉淀 | 说明试液中一定含有SO42- |
| B | 分别向两支试管中加入等体积、等浓度的过氧化氢溶液,再在其中一支试管中加入少量MnO2 | 研究催化剂对过氧化氢分解速率的影响 |
| C | 将Na2CO3与HCl两种溶液相互滴加 | 可以鉴别这两种溶液 |
| D | C2H5Br与AgNO3溶液混合加热 | 检验C2H5Br中的溴元素 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①④ | C、①③ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Be能在空气中燃烧 |
| B、BeO熔点较低 |
| C、BeCl2是共价化合物 |
| D、Be(OH)2具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B、样品中CuO的质量为4.0g |
| C、V=448 |
| D、原样品中Fe元素的质量分数为41% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气极易溶于水,可做喷泉实验 |
| B、硅是制造太阳能电池的常用材料 |
| C、NO2与水反应,它既是氧化剂又是还原剂 |
| D、用铁与稀硝酸反应来制备氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V (H2)=0.03mol/(L?min) |
| B、V(N2)=0.2mol/(L?min) |
| C、V (NH3)=0.02mol/(L?min) |
| D、V (NH3)=0.2mol/(L?min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com