
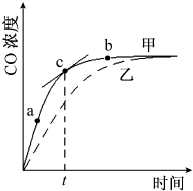
 ①在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是CD.
①在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是CD.分析 (1)依据X中Al与O的质量比为6.75:2计算物质的量之比得到化学式;
(2)①A、图象中可以得到单位时间内的浓度变化,反应速率是单位时间内物质的浓度变化;
B、c点处的切线的斜率是此时刻物质浓度除以此时刻时间为瞬时速率;
C、化学反应速率之比等于化学方程式计量数之比分析;
D、维持温度、容积不变,若减少N2的物质的量进行反应,平衡逆向进行,达到新的平衡状态;
②若温度不变,反应体系的压强减小为0.5p,平衡向气体体积增大的方向进行,平衡正向进行;
③该反应只有在高温下才能自发进行,结合反应自发进行的判断依据是△H-T△S<0分析;
(3)根据题目信息:AlN溶于强碱溶液时会生成NH3来书写方程式.
解答 解:(1)X中Al与O的质量比为6.75:2计算物质的量之比=$\frac{6.75}{27}$:$\frac{2}{16}$=0.25:0.125=2:1,化学式为:Al2O,
故答案为:Al2O;
(2)①A、图象中可以得到单位时间内的浓度变化,反应速率是单位时间内物质的浓度变化计算得到,从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率,故A正确;
B、c点处的切线的斜率是此时刻物质浓度除以此时刻时间,为一氧化碳的瞬时速率,故B正确;
C、化学反应速率之比等于化学方程式计量数之比分析,3v(N2)=v(CO),故C错误;
D、维持温度、容积不变,若减少N2的物质的量进行反应,平衡逆向进行,达到新的平衡状态,平衡状态与原来的平衡状态不同,故D错误;
故答案为:CD;
②若温度不变,反应体系的压强减小为0.5p,平衡向气体体积增大的方向进行,平衡正向进行,N2的平衡转化率增大,平衡时CO的物质的量浓度增大,CO的物质的量浓度大于0.5c,小于c,故选B,
故答案为:>;B;
③Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g),反应的熵变大于0,该反应只有在高温下才能自发进行,则△H>0,温度升高平衡正向进行,反应物Al2O3的平衡转化率将增大,
故答案为:增大;该反应在高温下自发,且△S>0,所在△H>0,即正反应为吸热反应,升高温度,平衡向正方向移动;
(3)根据题目信息:AlN溶于强碱溶液时会生成NH3,化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑.
点评 本题考查了化学平衡影响因素分析判断,化学方程式书写方法,主要是图象分析应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该装置为原电池 | |
| B. | a极上发生还原反应 | |
| C. | 电子由b→a | |
| D. | 该过程中能量的转换只有化学能与电能的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 此装置为原电池,铜片上有气泡产生 | |
| B. | 铜片质量逐渐减少 | |
| C. | 电流从锌片经导线流向铜片 | |
| D. | 氢离子在铜片表面被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有乙烯 | |
| B. | 可能为等物质的量甲烷和丙烯的混合物 | |
| C. | 可能为乙烷和丙烷的混合物 | |
| D. | 一定为乙烯和甲烷的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com