
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)
(1)向一定物质的量浓度的Cu(NO3)2 和Mn(NO3)2 溶液中加入Na2CO3 溶液,所得沉淀经高温灼烧,可制得CuMn2O4,NO3﹣的空间构型是______________________(用文字描述).
(2)在铜锰氧化物的催化下,CO 被氧化为CO2,HCHO 被氧化为CO2 和H2O.
①根据等电子体原理,CO 分子的结构式为____________.
②H2O 分子中O 原子轨道的杂化类型为____________.
③1mol CO2 中含有的σ键数目为__________________.
(3)H2SeO3的K1和K2分别为2.7×10﹣3和2.5×10﹣8,H2SeO4第一步几乎完全电离,K2为1.2×10﹣2,请根据结构与性质的关系解释:H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:_______________________________________;
【答案】平面三角形 C≡O sp3杂化 2×6.02×1023个 第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子
【解析】
(1)利用价层电子对互斥模型判断;
(2)①根据N2与CO为等电子体,结合等电子体结构相似判断;
②根据中心原子形成的δ键和孤电子对数判断杂化类型;
③据CO2的结构式O=C=O判断;
(3)从一级电离得到的离子分析;
(1)![]() 中孤对电子
中孤对电子![]() ,价层电子对个数=3+0=3,则C采取sp2杂化,空间构型为平面三角形;
,价层电子对个数=3+0=3,则C采取sp2杂化,空间构型为平面三角形;
答案为:平面三角形;
(2)N2与CO为等电子体,二者结构相似,N2的结构为N≡N,则CO的结构为C≡O;
故答案为:C≡O;
②H2O 分子中O形成2个δ键,孤电子对数为![]() ,所以价层电子对数为4,则为sp3杂化;
,所以价层电子对数为4,则为sp3杂化;
故答案为:sp3;
③CO2的结构式为O=C=O,分子中C形成2个δ键,则1molCO2中含有的σ键的物质的量为2mol,数目为2×6.02×1023或2NA;
故答案为:2×6.02×1023;
(3) 酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离,所以第一步电离程度大于第二步电离;
答案为:第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子。


科目:高中化学 来源: 题型:
【题目】已知:一个碳原子上连多个羟基时不稳定:![]() 。烃A有如下的转化关系:
。烃A有如下的转化关系:

![]() 写出物质C的结构简式: ______ ,反应⑥的反应类型是 ______ 。
写出物质C的结构简式: ______ ,反应⑥的反应类型是 ______ 。
![]() 中含氧官能团的名称为 ______ ,D的核磁共振氢谱中将会出现 ______ 组吸收峰。
中含氧官能团的名称为 ______ ,D的核磁共振氢谱中将会出现 ______ 组吸收峰。
![]() 写出C与银氨溶液反应的化学方程式: ______ 。
写出C与银氨溶液反应的化学方程式: ______ 。
![]() 与G具有相同官能团的同分异构体有四种,其中两种为:
与G具有相同官能团的同分异构体有四种,其中两种为: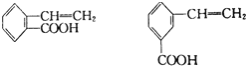 请写出其它两种的结构简式: ______ 、 ______ 。
请写出其它两种的结构简式: ______ 、 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡金属元素。A、B、C同周期,C、D同主族,A的原子结构示意图为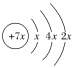 ,B的核外电子排布式为1s22s22p63s1,C的最外层有三个未成对电子,E的价电子排布式为3d64s2。试回答下列问题:
,B的核外电子排布式为1s22s22p63s1,C的最外层有三个未成对电子,E的价电子排布式为3d64s2。试回答下列问题:
(1)写出下列元素的名称:A__________,C________。
(2)E元素原子的未成对电子数是________,E元素在周期表中位于第________周期______族;已知元素周期表可按电子排布分为s区、p区、d区等,则E元素在______区。
(3)画出D的核外电子排布图:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05molB.1molC.1.05molD.0.13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是
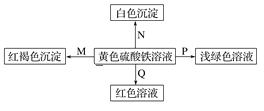
选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | KSCN |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 铁粉 | KSCN |
D | Na2O2 | MgCl2 | 锌粉 | KSCN |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的Al2(SO4)3、较多的Cu2+和少量的Na+。从工业废水中回收金属铝和金属铜的工艺流程如下图所示(试剂X、Y、Z均过量)。

(1)试剂X为_______,加入试剂X发生的离子方程式是___________试剂Z为___________。
(2)操作②为____________(填实验分离方法)。
(3)溶液2中含有的溶质有__________(填化学式)。
(4)写出操作④的化学反应方程式____________。
(5)金属铜能与浓硫酸在加热的条件下发生反应,产生的气体为_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
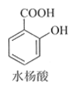 +(CH3CO)2O(醋酸酐)
+(CH3CO)2O(醋酸酐)![]()
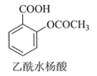 +CH3COOH
+CH3COOH
水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | 72~ 74 | 135~138 |
相对密度/(g · cm3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右, 充分反应。稍冷后进行如下操作:
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。回答下列问题:
(1)该合成反应中应采用_____加热。(填标号)
A 热水浴 B 酒精灯 C 煤气灯 D 电炉
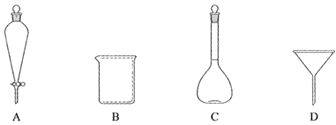
(2)下列玻璃仪器中,①中需使用的有_____(填标号)。
(3)①中需使用冷水,目的是_____。
(4)②中饱和碳酸氢钠的作用是_____,以便过滤除去难溶杂质。
(5)④采用的纯化方法为_____。
(6)本实验的产率是_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是典型微生物燃料电池原理示意图。若用含硝酸盐废水替代图中氧气,可达到废水处理的目的(已知:a室中微生物降解有机物产生e-、CO2和H+)。关于该电池,下列说法不正确的是

A.H+通过质子交换膜从a室进入b室
B.a室内发生氧化反应,电极为正极
C.b室内发生的电极反应为:O2+4e-+4H+=2H2O
D.将硝酸盐转化为N2时,电极反应为:2NO3-+10e-+12H+=N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,海水资源的利用前景广阔,从海水中提取镁的主要步骤如图所示,下列说法正确的是
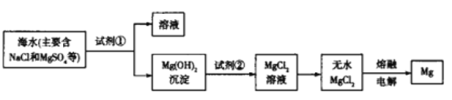
A.工业上利用NaOH溶液使Mg2+转化为Mg(OH)2
B.与Mg同周期的金属都可以采用电解熔融的无水氯化物来制备
C.试剂②可以选用盐酸
D.工业上也可以将Mg(OH)2煅烧分解为MgO,通过电解熔融MgO制取Mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com