
【题目】甲醇是一种可再生的绿色能源,![]() 是一种温室气体,都是重要的化工原料。
是一种温室气体,都是重要的化工原料。
(1)已知CO(g)+2H2(g)![]() CH3OH(1);ΔH=-129kJ·mol1,该反应的ΔS_________(填“>”或“<”)0。
CH3OH(1);ΔH=-129kJ·mol1,该反应的ΔS_________(填“>”或“<”)0。
(2)向温度不同容积均为1L的a、b、c、d、e五个恒容密闭容器中各充入3molCO2、7molH2的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH=QkJ·mol1,反应过程中维持各容器温度不变,测得t1时刻各容器中H2O的体积分数(H2O)如图所示。
CH3OH(g)+H2O(g)ΔH=QkJ·mol1,反应过程中维持各容器温度不变,测得t1时刻各容器中H2O的体积分数(H2O)如图所示。
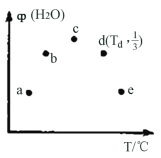
①Q_______(填“>”或“<”)0,五个容器中肯定处于非平衡状态的是_________。
②t1时刻时,容器a中正反应速率________(填“大于”“小于”或“等于”)容器e中正反应速率;
③Td℃时,该反应的平衡常数K=__________;
④欲提高H2的转化率,可采取的措施有______________________,(写出两种);
(3)碳捕捉技术的应用既可降低碳排放也可得到重要的化工产品.
①请写出CO2的电子式_______________________________。
②NaOH溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(NaHCO3)∶c(Na2CO3)=1∶1,则所得溶液的离子浓度的大小关系是____________。
③在清除锅炉水垢的过程中,需要用Na2CO3将水垢中的CaSO4转化为CaCO3,将微溶的CaSO4难溶性的CaCO3的理由是____________________________________。
【答案】< < a、b 小于 4 降低温度、增大二氧化碳的量、增大压强 ![]() c(Na+)> c(HCO
c(Na+)> c(HCO![]() )>c(CO
)>c(CO![]() )> c(OHˉ)>c(H+) CaSO4难溶于酸,而CaCO3易溶于酸中
)> c(OHˉ)>c(H+) CaSO4难溶于酸,而CaCO3易溶于酸中
【解析】
(2)图示各点表示t1时刻各容器中H2O的体积分数(H2O),据图可知c点之前随温度上升H2O的体积分数增大,c点之后随温度的上升减小,说明在c点之前a、b两点在t1时刻时反应还未达到平衡,c点之后的d、e二点反应达到平衡;且随温度升高,平衡时水的体积分数减小,说明升高温度,平衡逆向移动,正反应为放热反应。
(1)该反应是气体减少的反应,所以ΔS<0;
(2)①根据分析可知该反应正反应为放热反应,焓变小于零,所Q<0;五个容器中肯定处于非平衡状态的是a、b;
②容器a中温度小于容器e中的温度,两容器中水的体积分数相差不大,所以速率主要受温度影响,则容器a中正反应速率小于容器e中正反应速率;
③初始投料为3molCO2、7molH2,设平衡时转化的CO2为x,容器体积为1L,列三段式有:

该温度下平衡时H2O的体积分数为![]() ,则有
,则有![]() ,解得x=2,所以平衡时CO2、H2、CH3OH、H2O的浓度分别为1mol/L、1mol/L、2mol/L、2mol/L,平衡常数K=
,解得x=2,所以平衡时CO2、H2、CH3OH、H2O的浓度分别为1mol/L、1mol/L、2mol/L、2mol/L,平衡常数K=![]() =4;
=4;
④该反应为体积减小的放热反应,所以欲提高H2的转化率,可以降低温度或者增大二氧化碳的量或者增大压强;
(3)①CO2为共价化合物,其电子式为![]() ;
;
②溶液中c(NaHCO3)∶c(Na2CO3)=1∶1,钠离子不发生水解,所以c(Na+)最大,碳酸根的水解程度大于碳酸氢根,所以c(HCO![]() )>c(CO
)>c(CO![]() ),碳酸根和碳酸氢根的水解使溶液显碱性,所以c(OHˉ)>c(H+),水解是微弱的,则溶液中c(Na+)> c(HCO
),碳酸根和碳酸氢根的水解使溶液显碱性,所以c(OHˉ)>c(H+),水解是微弱的,则溶液中c(Na+)> c(HCO![]() )>c(CO
)>c(CO![]() )> c(OHˉ)>c(H+)
)> c(OHˉ)>c(H+)
③因为CaSO4难溶于酸,难除去,而CaCO3易溶于酸中从而易除去,所以在清除锅炉水垢的过程中,需要用Na2CO3将水垢中的CaSO4转化为CaCO3。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】用双线桥法标出下列反应电子转移的方向和数目。
(1)4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O_________________
MnCl2+Cl2↑+2H2O_________________
(2)2KClO3![]() 2KCl+3O2↑__________
2KCl+3O2↑__________
(3)Cl2+2NaOH===NaClO+NaCl+H2O__________
(4)2H2O2![]() 2H2O+O2↑__________
2H2O+O2↑__________
(5)S+2H2SO4(浓)![]() 3SO2↑+2H2O__________
3SO2↑+2H2O__________
(6)6HCl+KClO3===3Cl2↑+KCl+3H2O__________
(7)3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O__________
(8)2KMnO4![]() K2MnO4+MnO2+O2↑__________
K2MnO4+MnO2+O2↑__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确______。
②乙直接加热饱和FeCl3溶液,请评价是否正确______。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(3)写出制备Fe(OH)3胶体的化学方程式: ____________________。证明有Fe(OH)3胶体生成的实验操作是_____________________。该操作利用胶体的性质是________。
(4)Fe(OH)3胶体稳定存在的主要原因是____________________(填字母,下同)。
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是_____________,这种现象称为胶体的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在大试管内将足量NaHCO3加热到 200℃,将产生的混合气体通入到盛有1.87 g Na2O和Na2O2的密闭容器中,待Na2O和Na2O2全部反应后,得到标准状况下224 mL O2;再将反应后密闭容器内的固体全部溶于水配成 100 mL 溶液。下列说法正确的是
A.Na2O和Na2O2 均为碱性氧化物
B.参加反应的NaHCO3物质的量为 0.04 mol
C.反应过程中总共转移 0.04 mol 电子
D.配成的 100 mL 溶液中 c(Na+) = 0.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为CO2与CH4转化为CH3COOH的反应历程(中间体的能量关系如虚框中曲线所示),图2为室温下某溶液中CH3COOH和CH3COO-两种微粒浓度随pH变化的曲线。下列结论错误的是
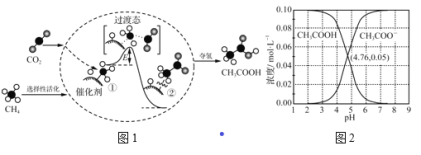
A. CH4分子在催化剂表面会断开C—H键,断键会吸收能量
B. 中间体①的能量大于中间体②的能量
C. 室温下,CH3COOH的电离常数Ka=10-4.76
D. 升高温度,图2中两条曲线交点会向pH增大方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol,则![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)的ΔH为( )
Cl2(g)=HCl(g)的ΔH为( )
A.+184.6kJ/molB.-92.3kJ/molC.-369.2kJ/molD.+92.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬(Cr)硬度大抗腐蚀性和耐磨性好,具有广泛的应用前景一种以铬铁矿(含FeCr2O4及少量Al2O3SiO2等)为原料制备金属铬的工艺流程如下:
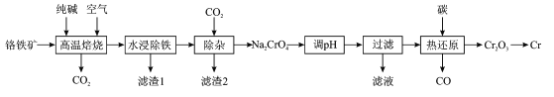
回答下列问题:
(1)“高温焙烧”中主要反应的化学方程式为____
(2)为提高“水浸”的浸取率,除了适当升高温度,还可采取的措施是____
(3)“滤渣1”是一种红棕色固体,为检验其中的金属元素,可选择的常用试剂是____“滤渣2”的主要成分是__________
(4)“调pH”的目的是____
(5)“热还原”主要是利用焦炭与重铬酸盐得到Cr2O3和另一种固体产物,该固体产物可返回__________工序循环使用
(6)可用铝热法还原Cr2O3制备铬单质,铝热反应中镁带的作用是____;还可用惰性电极电解硫酸铬钾[KCr(SO4)2]溶液制备,阴极的电极反应式为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生反应 m A (g) + n B (g) ![]() p C (g)达到平衡后,温度不变,将容器体积缩小到原来的1/2,达到平衡时,C的浓度为原来的1.5倍,则下列说法正确的是
p C (g)达到平衡后,温度不变,将容器体积缩小到原来的1/2,达到平衡时,C的浓度为原来的1.5倍,则下列说法正确的是
A. m + n > pB. C的体积分数增加
C. 平衡向正反应方向移动D. A 的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com