
【题目】2013年中国水周的主题是:“节约保护水资源,大力建设生态文明”.
(1)ClO2和Cl2(还原产物都为Cl﹣)是生活中常用的净水消毒剂.当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的_________倍.
(2)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作流程和有关现象如图所示:操作③的相关图象如图
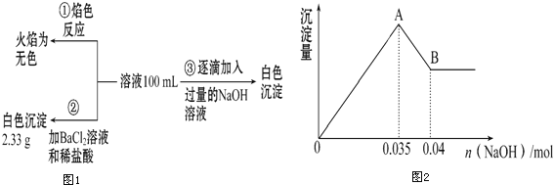
请根据上图回答下列问题:
①实验中需配制1.0molL﹣1的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为_______________.
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为___________.
③试确定NO3-是否存在?________(填“存在”“不存在”或“不确定”),若存在,试计算c(NO3-)=_____(若不存在,此问不必作答).
【答案】2.5 100mL容量瓶 Al(OH)3+OH﹣=AlO2﹣+2H2O 存在 0.15mol/L
【解析】
(1)ClO2和Cl2的还原产物都为Cl﹣,则反应中Cl元素化合价分别由+4价、0价降低到﹣1价,化合价分别变化5、1,则ClO2的消毒效率是Cl2的![]() =2.5倍,故答案为:2.5;
=2.5倍,故答案为:2.5;
(2)①配制1.0mol/L的NaOH溶液100mL,根据实验步骤所需仪器有:玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管、100mL容量瓶,故答案为:100mL容量瓶;
②实验③中A→B过程是Al(OH)3与OH﹣发生反应,其方程式为Al(OH)3+OH﹣=AlO2﹣+2H2O,故答案为:Al(OH)3+OH﹣=AlO2﹣+2H2O;
③无色废水确定无Fe3+,根据实验①确定无Na+,根据实验②确定有SO42﹣,根据实验③确定有Al3+和Mg2+,因为CO32﹣与Al3+不能共存,所以无CO32﹣;故溶液中存在的离子为:Al3+、Mg2+、SO42﹣,已知硫酸钡沉淀为2.33g,则n(SO42﹣)=2.33g÷233g/mol=0.01mol,根据图象可知与Al(OH)3反应的OH﹣为:n(OH﹣)=0.005mol,由Al(OH)3+OH﹣=AlO2﹣+2H2O、 Mg2++2OH﹣=Mg(OH)2↓可知,n(Al3+)=0.005mol, n(Mg2+) 0.035﹣3n(Al3+)=0.01mol,溶液中Mg2+和Al3+所带正电荷总量与SO42﹣所带负电荷总量不相等,因此存在NO3﹣,设NO3﹣物质的量为n mol,根据电荷守恒得:3n(Al3+)+2n(Mg2+)=2n(SO42﹣)+n(NO3﹣),所以n(NO3﹣)=0.015mol, c(NO3﹣)=0.015mol÷0.1L=0.15mol/L,故答案为:存在;0.15mol/L。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】已知:① R-NO2![]() R-NH2;
R-NH2;
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯为原料制备某些化合物的转化关系图:
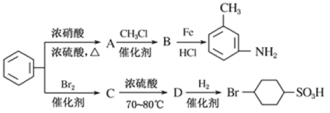
(1)A 转化为B 的化学方程式是____________________________;
(2)在“![]() ”的所有反应中属于取代反应的是______________(填字母),属于加成反应的是__________________(填字母);C 转化为D 的化学方程式是_________________;
”的所有反应中属于取代反应的是______________(填字母),属于加成反应的是__________________(填字母);C 转化为D 的化学方程式是_________________;
(3)B 中苯环上的一氯代物有_______________种同分异构体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。

实验Ⅰ
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
(NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是_______(用化学用语表示)。溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”) 。
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验Ⅱ,否定了该观点,补全该实验。
操作 | 现象 |
取_______,加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(3)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验Ⅲ:分别配制0.80 mol·L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应 4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+
4Fe(OH)3+8H+
由实验III,乙同学可得出的结论是_______,原因是_______。
(4)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是_____。

(5)综合以上实验,增强Fe2+稳定性的措施有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.0.1mol苯中含有的碳碳双键数为0.3NA
B.1molNO2与足量H2O反应,转移的电子数为NA
C.标准状况下,11.2L CO和CO2混合物含有碳原子数为0.5NA
D.密闭容器中,1 molN2与4molH2充分反应生成的NH3分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系。
(1)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJmol-1)
化学键 | H-H | Cl-Cl | H-Cl |
键能/(kJmol-1) | 436 | 243 | 431 |
根据以上信息可知,1molH2在足量的氯气中燃烧生成氯化氢气体放出的热量是_______
(2)工业上有一种方法是用CO2来生产燃料甲醇,可以将CO2变废为宝。在体积为1L的密闭容器中充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
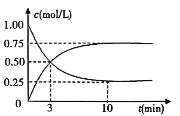
①从反应开始到平衡,CH3OH的平均反应速率υ(CH3OH)=_______________。
②若反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.υ(CO2)=0.15molL-1min-1 B.υ(H2)=0.01molL-1s-1
C.υ(CH3OH)=0.2molL-1min-1 D.υ(H2O)=0.45molL-1min-1
该反应进行由快到慢的顺序为___________(填字母)
(3)海水化学资源的利用具有非常广阔的前景,从海水中提取溴的工业流程如图所示:
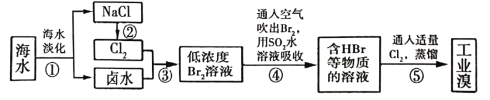
①以上五个过程中涉及氧化还原反应的有_____________个。
②步骤③中已获得游离态的溴,步骤④又随之转变成化合态的溴,其目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有δ、γ、α三种同素异形体,其晶胞结构如图所示,下列判断正确的是
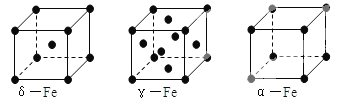
A. δ、γ、α铁晶体中存在金属阳离子和阴离子
B. γ—铁晶体晶胞中所含有的铁原子数为14
C. δ、α两种晶胞中铁原子的配位数之比为4∶3
D. 若α-Fe晶胞边长为a cm,γ-Fe晶胞边长为b cm,则两种晶体的密度比为b3∶a3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键的断裂和新键的形成过程。化学键的键能是形成化学键时释放的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198P—O:360O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为 ( )
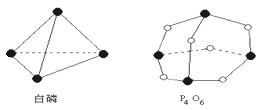
A. -1638 kJ·mol-1B. +1638 kJ·mol-1C. -126 kJ·mol-1D. +126 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,不同氢原子的核磁共振氢谱中给出的峰值(信号)不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。如乙醚的结构简式为CH3—CH2—O—CH2—CH3,其核磁共振氢谱中给出的峰值(信号)有两种。化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,则A的结构简式为________________,请预测B的核磁共振氢谱上有________种峰值(信号)。
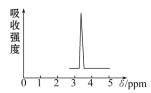
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘海醇是一种非离子型X-CT造影剂。下面是以化合物A(分子式为C8H10的苯的同系物)为原料合成碘海醇的合成路线[R为-CH2CH(OH)CH2OH]:
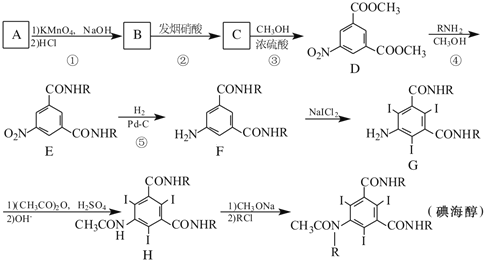
(1)写出A的结构简式:____________。
(2)反应①-⑤中,属于取代反应的是____________(填序号).
(3)写出C中含氧官能团的名称:硝基、____________。
(4)写出同时满足下列条件的D的两种同分异构体的结构简式:____________。
Ⅰ.含1个手性碳原子的α-氨基酸
Ⅱ.苯环上有3个取代基,分子中有6种不同化学环境的氢
Ⅲ.能发生银镜反应,水解产物之一能与FeCl3溶液发生显色反应
(5)已知:①![]()
②![]() 呈弱碱性,易被氧化
呈弱碱性,易被氧化
请写出以![]() 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体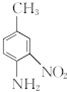 的合成路线流程图(无机试剂任用)____________________。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)____________________。合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com