
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H3PO4 | K1=7.11×10-3 |
| H3PO3 | K1=3.7×10-2 | K2=6.23×10-8 | |
| K2=2.9×10-7 | K3=4.5×10-13 |


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
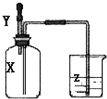 如图所示,集气瓶内充满某气体X,将滴管内的溶液Y挤入集气瓶后,烧杯中的溶液Z会进入集气瓶,然后又会有溶液被压回烧杯,则下列组合正确的是( )
如图所示,集气瓶内充满某气体X,将滴管内的溶液Y挤入集气瓶后,烧杯中的溶液Z会进入集气瓶,然后又会有溶液被压回烧杯,则下列组合正确的是( )| ① | X是甲烷,Y是高锰酸钾溶液,Z水 |
| ② | X是HCl,Y是浓硫酸,Z溴水 |
| ③ | X是氨气,Y是盐酸,Z浓氢氧化钠溶液 |
| ④ | X是SO2,Y是氢氧化钠溶液,Z浓硫酸 |
| A、①② | B、②④ | C、③④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
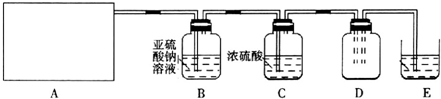
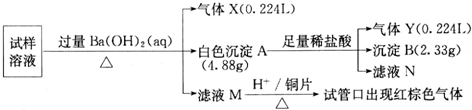
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管Ⅰ中,滴加 | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管Ⅱ中,滴加 过量Ba(NO3)2溶液振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管Ⅱ中的上层清液于试管Ⅲ中,滴加 | 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
| 实验步骤 | 实验操作 | ||||
| Ⅰ | 取少量质量的FeCO2固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 | ||||
| Ⅱ | 取少量实验步骤Ⅰ所得固体放于一洁净的试管中,用足量的稀硫酸溶解 | ||||
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 | ||||
甲同学的结论:4FeCO3+O2
| |||||
查看答案和解析>>
科目:高中化学 来源: 题型:
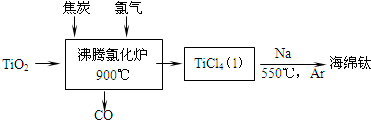
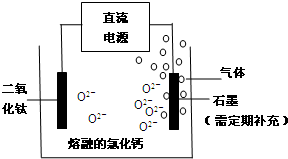
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在5 min 内该反应用C的浓度变化表示的反应速率为0.02 mol/(L?min) |
| B、5 min 时,容器内D的浓度为0.2 mol/L |
| C、该可逆反应随反应的进行,容器内压强逐渐增大 |
| D、5 min时容器内气体总的物质的量为3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
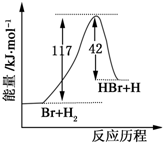
| A、反应物具有的总能量大于生成物具有的总能量 |
| B、正反应为吸热反应 |
| C、逆反应为吸热反应 |
| D、从图中可看出,该反应的反应热与反应途径有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3OH被氧化,表现氧化性 |
| B、此条件下还原性强弱为:N2>CH3OH |
| C、若氧化产物比还原产物多0.2mol,则该反应中转移3mol |
| D、该反应过程中断裂的化学键既有极性键又有非极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com