
| 实验序号 | 高锰酸钾溶液体积(ml) | 废水样品的体积(ml) |
| 1 | 10.02 | 25.00 |
| 2 | 10.62 | 25.00 |
| 3 | 9.98 | 25.00 |
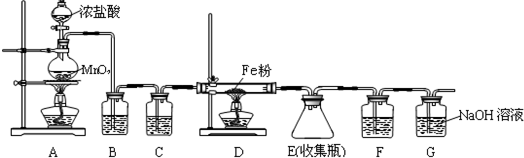
分析 I.(1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)根据n=cV和m=nM来计算;
(3)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
II.(4)A、盐酸能和高锰酸钾反应;
B、Fe2+能被硝酸氧化;
C、硫酸不干扰Fe2+和KMnO4的反应;
(5)Fe2+和MnO4-在酸性条件下反应,Fe2+被氧化为Fe3+,MnO4-被还原为Mn2+,据此分析;
(6)先判断滴定数据的有效性,然后依据实验过程和滴定实验消耗的高锰酸钾溶液体积的平均数,结合氧化还原反应离子方程式计算亚铁离子物质的量,计算25ml溶液中亚铁离子的浓度.
解答 解:I.(1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知需要的仪器有烧杯、量筒、玻璃棒、500mL容量瓶和胶头滴管,故还缺少的仪器有:500mL容量瓶和胶头滴管,故答案为:500mL容量瓶和胶头滴管;
(2)所需的高锰酸钾溶液的质量m=CVM=0.10mol/L×0.5L×158g/mol=7.9g,故答案为:7.9;
(3)若定容时俯视液面,则溶液体积偏小,故浓度偏高,故答案为:偏高;
II.(4)此实验是要用高锰酸钾溶液来滴定工业废水中铁元素的含量(全部铁元素以Fe2+形式存在).
A、由于盐酸能和高锰酸钾发生氧化还原反应,故向待测液中加盐酸会导致消耗的高锰酸钾的量偏多,从而造成误差,故A错误;
B、Fe2+能被硝酸氧化,故若加入硝酸,则会导致消耗的高锰酸钾的量偏少,则测得待测液中的Fe2+的浓度偏低,故B错误;
C、硫酸不干扰Fe2+和KMnO4的反应,故可以用硫酸酸化,故C正确.
故选C.
(5)Fe2+和MnO4-在酸性条件下反应,Fe2+被氧化为Fe3+,MnO4-被还原为Mn2+,故离子方程式为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,
故答案为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O;
(6)由于第二次滴定数据误差过大,应该舍去,所以滴定过程中高锰酸钾溶液平均消耗体积=$\frac{10.02+9.98}{2}$mL=10.00ml;
氧化还原反应为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,设亚铁离子物质的量为x,
5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
5 1
x 0.1mol/L×0.01L
x=5×0.1mol/L×0.01L=0.005mol,
c(Fe2+)=$\frac{0.005mol}{0.025L}$=0.2mol/L,
故答案为:0.2.
点评 本题考查物质成分和含量的测定,涉及仪器选用、误差分析、质量分数计算等知识,具有较强的综合性,解题时注意根据方程式来计算的方法,本题难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中滴入石蕊试液后溶液呈蓝色,证明该溶液一定是碱的溶液 | |
| B. | 向某无色溶液中滴入硝酸银溶液产生白色沉淀,证明该溶液一定是盐酸 | |
| C. | 某白色固体与熟石灰混合研磨后产生有刺激性的氨味,证明该固体是铵盐 | |
| D. | 向某固体中加入稀盐酸产生气泡,证明该固体一定是碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原电池是化学对人类的一项重大贡献.
原电池是化学对人类的一项重大贡献.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,减小容器体积,平衡不移动 | |
| B. | 其他条件不变,增大c(A),A的转化率增大 | |
| C. | 降低温度,v正增大,v逆减小 | |
| D. | v正(A)═2v逆(C) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com