
分析 ①CO32-的水解分两步,而HCO3-既能水解又能电离,据此分析离子种类;
②依据碳酸钠水解平衡分析,加入氢氧化钠增大氢氧根离子浓度,平衡左移;碳酸氢钠溶液中加入氢氧化钠溶液,氢氧根离子和碳酸氢根离子电离出的氢离子反应.促进电离正向进行;
解答 解:①CO32-的水解分两步进行:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,故Na2CO3溶液中存在Na+、CO32-、HCO3-、H2CO3、OH-、H+、H2O,而HCO3-既能水解又能电离:HCO3-+H2O?H2CO3+OH-,HCO3-?H++CO32-,故故NaHCO3溶液中存在Na+、CO32-、HCO3-、H2CO3、OH-、H+、H2O,所以两种溶液中微粒种类相同,
故答案为:=;
②依据碳酸钠水解平衡分析,加入氢氧化钠增大氢氧根离子浓度,平衡左移,碳酸根离子浓度增大;碳酸氢钠溶液中加入氢氧化钠溶液,氢氧根离子和碳酸氢根离子电离出的氢离子反应.促进电离正向进行,碳酸氢根离子浓度减小,
故答案为:增大;减小;
点评 本题考查了盐类水解的分析应用,注意加入物质对水解平衡的影响,题目难度中等.


科目:高中化学 来源: 题型:选择题
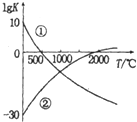 氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,如图表示两个常见固氮反应的平衡常数对数值(IgK)与温度的关系:
氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,如图表示两个常见固氮反应的平衡常数对数值(IgK)与温度的关系:| A. | 反应①和②均为放热反应 | |
| B. | 升高温度,反应①的反应速率减小 | |
| C. | 在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大 | |
| D. | 在1000℃时,反应①和反应②体系中N2的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4句 | B. | 5句 | C. | 6句 | D. | 7句 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在电解水实验中,加入硫酸钠可以提高电解效率 | |
| B. | 碳酸氢钠溶液与硫酸铝溶液混合有沉淀和气体生成 | |
| C. | 铁制品在海水中比在纯水中更易腐蚀 | |
| D. | 在双氧水中加FeCl3溶液可使产生O2速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| B. | 将标准状况下的2.24LCO2通入150mL 1mol•L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-) | |
| C. | 0.1mol•L-1的醋酸pH=a,0.01mol•L-1的醋酸pH=b,则a+1>b | |
| D. | 常温时①pH=12的氨水②pH=12的NaOH溶液,将两溶液稀释相同倍数后溶液的pH:②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
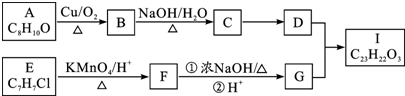
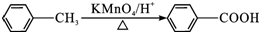
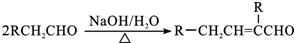
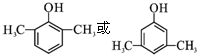
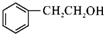 ,C→D的反应类型为加成反应,F中不含氧的官能团的名称为氯原子,I的结构简式为
,C→D的反应类型为加成反应,F中不含氧的官能团的名称为氯原子,I的结构简式为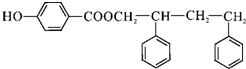 .
. ,F→G①的化学方程式为
,F→G①的化学方程式为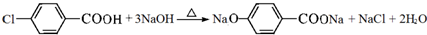 .
.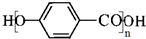 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将体积缩小为原来的一半,当体系再次达到平衡时,C02的浓度为原来的2倍 | |
| B. | CaCO3(s)加热分解生成Ca0(s)和C02,△s<0 | |
| C. | 将体积增大为原来的2倍,再次达到平衡时,气体密度不变 | |
| D. | 保持容器体积不变,充入He,平衡向逆反应方向进行. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com