
在一密闭容器中发生反应:2X(g)+Y(g)aZ(g) ΔH=Q kJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )

A.图甲,p1>p2,a<3
B.图甲,T1<T2,Q>0
C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D.图乙,如果a=3,t2时表示向体系中加入了催化剂
科目:高中化学 来源: 题型:
某校研究性学习小组同学在实验时把SO2通入装有1mol/LBaCl2溶液的试管中,出现了白色浑浊物。
(1)实验小组的同学根据沉淀溶解平衡原理查阅了工具书上的相关数据,经过计算推导得出:常温下即使把SO2通入1mol/L BaCl2溶液中至饱和,也不可能生成BaSO3沉淀,故白色浑浊物只能是BaSO4。你认为所查阅的数据为: 。
(2)二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液中氧气的影响很快便能观察到沉淀现象.为了避免产生沉淀,某化学小组设计了如下实验装置,实验操作步骤如下:

①气密性检查完好后,在装置A中的多孔隔板上放上锌粒,通过 全【品教学网, 用后离不了!注入稀硫酸.打开活塞,将产生的氢气导入到后续装置.
②D中气泡均匀冒出并验纯全【品教学网, 用后离不了!后关闭活塞,将装置D的导管插入烧杯中。
③通过装置B的 全【品教学网, 用后离不了!滴加浓硫酸,产生的气体进入到BaCl2溶液中,溶液保持澄清。
④打开活塞,将产生的氢气导入后续装置一段时间。
⑤将盛有BaCl2溶液的试管从装置中取出,拔去橡皮塞用胶头滴管伸入到苯层下方滴加双氧水,随即出现白色浑浊,滴加稀盐酸并振荡,白色浑浊不消失。
⑥拆卸装置,清洗仪器,处理剩余药品。
请回答下列问题
(2)实验步骤①和③的空白处使用的仪器名称分别为 、 全【品教学网, 用后离不了!;
(3)反应开始前,先向制取SO2的装置中通入纯净的A中产生的氢气,其作用是: 。
(4)装置C中苯的作用是 。
(5)装置D的目的是 全【品教学网, 用后离不了!
(6)写出实验步骤⑤试管中发生反应的化学方程式 、 全【品教学网, 用后离不了!;
查看答案和解析>>
科目:高中化学 来源: 题型:
18-II(14分)l,6-己二酸(G)是合成尼龙的主要原料之一,可 用含六个碳原子的有机化合物氧化制备。
用含六个碳原子的有机化合物氧化制备。 下图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F):
下图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F):
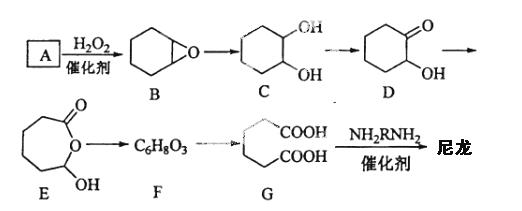
回答下列问题:
(1)化合物A中含碳87.8%,其余为氢,A的化学名称为_____________。
(2)B到C的反应类型为______________。
(3)F的结构简式为_____________。
(4)在上述中间物质中,核磁共振氢谱出峰最多的是__________,最少的是____。(填化合物代号)
(5)由G合成尼龙的化学方程式为________ ___________________。
___________________。
(6)由A通过两步反应制备1,3-环己二烯的合成路线 为________________________。
为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列材料的特性及用途的叙述不正确的是( )
A.氧化铝可用来制造人造牙齿
B.氮化硅陶瓷耐高温且不易传热,可用来制造柴油机
C.光导纤维传导光的性能很强,是非常好的通讯材料
D.人造刚玉硬度高,用于制造刚玉球磨机
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,分别对反应C(s)+CO2(g)2CO(g)(正向吸热)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是( )
A.①②③④ B.①③④
C.①② D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH=-Q kJ·mol-1(Q>0)
Si3N4(s)+12HCl(g) ΔH=-Q kJ·mol-1(Q>0)
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率为________
mol/(L·min);该反应的平衡常数表达式K=________。
(2)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
a.3v逆(N2)=v正(H2)
b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变
d.c(N2):c(H2):c(HCl)=1:3:6
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液中各组离子一定能大量共存的是 ( )
A.使甲基橙呈红色的溶液中:Na+、AlO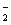 、NO
、NO 、CO
、CO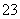
B.由水电离产生的c(H+)=10-12mol·L?-1的溶液:NH 、SO
、SO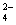 、HCO
、HCO 、Cl-
、Cl-
C.含有0.1 mol·L-1 HCO 的溶液:Na+、Fe3+、NO
的溶液:Na+、Fe3+、NO 、SCN-
、SCN-
D.  =0.1 mol·L-1的溶液:Na+、K+、CO
=0.1 mol·L-1的溶液:Na+、K+、CO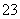 、NO
、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时有关弱电解质的电离平衡常数如下表:
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×l0–5 | 4.9×l0–10 | K1=4.3×l0–7 K2=5.6×l0–11 | 1.8×l0–5 |
根据上表中数据回答下列问题:
(1)CH3COO- 、CN- 、CO32-结合质子(即H+)的能力大小顺序___________________________;25℃时,有等浓度的①CH3COONa溶液、②NaCN溶液、③NaHCO3溶液,三种溶液的pH由大到小的顺序为 (填序号)。
(2) NaCN溶液中通入少量二氧化碳,反应的离子方程式为
(3)室温下,向盛一定量的稀氨水烧杯中逐滴加入物质的量浓度相同的醋酸,当恰好中和时,溶液的pH 7(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是[ ]
A.2.24 LH2含有的原子数为0.2NA
B.常温常压下,18 g NH4+的电子数为10 NA
C.标准状况下,1 NAH2O分子占有的体积约为22.4 L
D.0.5 mol /L的AlCl3溶液中,Cl- 的数目为1.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com