
 ,Cl的基态原子外围电子层排布式为3s23p5;
,Cl的基态原子外围电子层排布式为3s23p5;| 第一电离能 | 键能 | 沸点 |
| O>Na | H-Cl>H-Si | CO2<H2O |
 ;
;分析 (1)根据Si为14号元素,核外电子排布为2,8,4,根据电子层数=周期数,最外层电子数=主族数判断位置,铁原子为26号元素,则Fe2+的离子核外有24个电子,根据构造原理每一层上的电子数为2、8、14据此书写,Cl为17号元素,其基态原子外围电子层排布式即为最外层电子排布式;
(2)同一周期中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族元素大于第IIIA族元素,第VA族元素大于第VIA族元素;
键能与键长成反比,键长与半径成正比,据此分析;
分子晶体的熔沸点与是否存在氢键有关,存在氢键的熔沸点一般较高;
(3)根据漂白粉放空气中会转化成碳酸钙结合强酸制弱酸分析;
(4)根据题干信息,氯酸钠氧化浓盐酸生成氯化钠、氯气、二氧化氯、水;
(5)由钛铁矿(FeTiO3)可被一氯化碳还原为铁和TiO2固体,则方程式为FeTiO3+CO=TiO2+Fe+CO2,又已知消耗7克CO,吸收aKJ热量,所以消耗28克即1molCO,吸收4aKJ热量,据此书写热化学方程式.
解答 解:(1)Si为14号元素,核外电子排布为2、8、4,则电子层数=周期数,最外层电子数=主族数,所以硅在第三周期第ⅣA族;铁原子为26号元素,则Fe2+的离子核外有24个电子,根据构造原理每一层上的电子数为2、8、14,则Fe2+的离子结构示意图为 ;Cl为17号元素,其基态原子外围电子层排布式即为最外层电子排布式3s23p5;故答案为:三;ⅣA;
;Cl为17号元素,其基态原子外围电子层排布式即为最外层电子排布式3s23p5;故答案为:三;ⅣA; ;3s23p5;
;3s23p5;
(2)同一周期中,元素的第一电离能是指失去第一个电子的难易程度,氧属于第二周期,而钠属于第三周期,且钠最外层只有1个电子很容易失去,氧最外层有6个电子很难失去,所以第一电离能:O>Na;
键能与键长成反比,键长与半径成正比,又Cl的半径比硅小,所以H-Cl的键长比H-Si短,则H-Cl的键能比H-Si大;
分子晶体的熔沸点与是否存在氢键有关,存在氢键的熔沸点一般较高,又水分子间存在氢键,所以熔沸点:CO2<H2O;故答案为:>;>;<;
(3)漂白粉中的次氯酸钙与空气中的二氧化碳及水发生反应,生成碳酸钙和次氯酸反应的化学方程式为:Ca(ClO)2+CO2+H2O═CaCO3+2HClO,根据强酸制弱酸,则此方程式可以说明碳酸酸性比次氯酸强;
故答案为:Ca(ClO)2+CO2+H2O═CaCO3+2HClO;
(4)根据题干信息,氯酸钠氧化浓盐酸生成氯化钠、氯气、二氧化氯、水,该反应为2NaClO3+4HCl(浓)═2NaCl+Cl2↑+2ClO2↑+2H2O,双线桥标出电子转移的方向和数目为 ,故答案为:
,故答案为: ;
;
(5)由钛铁矿(FeTiO3)可被一氯化碳还原为铁和TiO2固体,则方程式为FeTiO3+CO=TiO2+Fe+CO2,又已知消耗7克CO,吸收aKJ热量,所以消耗28克即1molCO,吸收4aKJ热量,所以该反应的热化学方程式为FeTiO3(s)+CO(g)=TiO2(s)+Fe(s)+CO2(g))△H=+4aKJ•mol-1,
故答案为:FeTiO3(s)+CO(g)=TiO2(s)+Fe(s)+CO2(g))△H=+4aKJ•mol-1.
点评 本题考查知识点较多,涉及原子结构和元素周期律、反应热的计算、化学方程式书写和氧化还原反转移电子数的计算和表示方法,为高考常见题型,侧重于学生计算能力、分析比较能力的培养.


科目:高中化学 来源: 题型:选择题
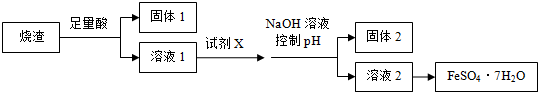
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2CN-+Cl2→(CN)2+2Cl- | B. | (CN)2+H2O→2H++CN-+CNO- | ||
| C. | (CN)2+2OH-→CN-+CNO-+H2O | D. | (SCN)2+2CN-→2SCN-+(CN)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的氧化铜粉末 | B. | 二氧化碳通过过氧化钠粉末 | ||
| C. | 铝与氧化铁发生铝热反应 | D. | 将锌粒投入硝酸铜溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种溶液pH的大小顺序:①>④>③>② | |
| B. | ①、②混合后pH>7,则混合溶液中c(NH4+)<c(NH3•H2O) | |
| C. | ①、②中分别加入25 mL 0.1 mol•L-1盐酸后,溶液中c(NH4+):①>② | |
| D. | ③、④中分别加入12.5 mL 0.1mol•L-1 NaOH溶液后,两溶液中离子种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )| A. | a点时升高温度,溶液pH增大 | |
| B. | b点c(CH3COO-)<c(CH3COOH) | |
| C. | c点对应的NaOH溶液的体积V=20mL | |
| D. | d点c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.
氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com