
【题目】一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.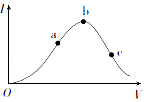
请回答:
(1)O点导电能力为0的理由是 .
(2)a、b、c三点处,溶液中c(H+)由小到大的顺序为 .
(3)a、b、c三点处,醋酸电离程度最大的是点.
(4)若使c点溶液中的c(CH3COO﹣)提高,下列措施中不可行的是
A.加热
B.加稀盐酸
C.加固体KOH
D.加水
E.加Zn粒
F.加固体CH3COONa
G.加MgO
I.加固体Na2CO3
【答案】
(1)在0点处还未加水,醋酸分子未电离,无自由移动的离子,所以导电能力为0
(2)c<a<b
(3)c
(4)B,D
【解析】解:(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸中没有自由移动的离子,所以冰醋酸不导电,所以答案是:在0点处还未加水,醋酸分子未电离,无自由移动的离子,所以导电能力为0;(2)导电能力越强,离子浓度越大,氢离子浓度越大,则a、b、c三点溶液的氢离子浓度关系为c<a<b,所以答案是:c<a<b;(3)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大,所以电离程度最大的是c,所以答案是:c;(4)A.醋酸是弱电解质,电离时需要吸收热量,所以加热促进醋酸电离,导致醋酸根离子浓度最大,故正确; B.加盐酸,抑制醋酸电离,所以醋酸根离子浓度减小,故错误; C.加KOH固体,KOH和醋酸发生中和反应生成醋酸钠,促进醋酸电离,溶液体积不变,醋酸根离子浓度增大,故正确; D.加水促进醋酸电离,但醋酸电离程度远远小于溶液体积增大程度,所以醋酸根离子浓度减小,故错误; E.加入锌粒,锌和氢离子发生置换反应而促进醋酸电离,则醋酸根离子浓度增大,故正确; F.加固体CH3COONa,醋酸钠电离出醋酸根离子导致醋酸根离子浓度增大,故正确; G.加MgO,MgO和氢离子反应而促进醋酸电离,则醋酸根离子浓度增大,故正确; H.加固体Na2CO3 , Na2CO3和氢离子反应而促进醋酸电离,则醋酸根离子浓度增大,故正确,所以答案是:BD.
【考点精析】利用弱电解质在水溶液中的电离平衡对题目进行判断即可得到答案,需要熟知当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


科目:高中化学 来源: 题型:
【题目】半导体工业用石英砂做原料通过三个重要反应生产单质硅:
①SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+682.44kJmol﹣1 ,
(石英砂) (粗硅)
②Si(s)+2Cl2(g)═SiCl4(g)△H=﹣657.01kJmol﹣1
③SiCl4(g)+2Mg(s)═2MgCl2(s)+Si(s)△H=﹣625.63kJmol﹣1
(纯硅)
用石英砂生产1.00kg纯硅的总放热为( )
A.2.43×104 kJ
B.2.35×104 kJ
C.2.23×104 kJ
D.2.14×104 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按酸、碱、盐分类顺次排列的是( )
A. 硫酸(H2SO4)、纯碱(Na2CO3)、食盐(NaCl)
B. 硝酸(HNO3)、烧碱(NaOH)、胆矾(CuSO45H2O)
C. 醋酸(CH3COOH)、乙醇(C2H5OH)、硫酸铵[(NH4)2SO4]
D. 盐酸(HCl)、熟石灰[Ca(OH)2]、苛性钠(NaOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于阿司匹林,下列说法正确的是( ) 
A.不能用FeCl3 溶液鉴别水杨酸和阿司匹林
B.服用阿司匹林出现水杨酸反应时,可静脉注射NaHCO3溶液
C.1 mol阿司匹林最多可消耗2 mol NaOH
D.该反应不属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(化学式:ClO2)是一种高效环保的自来水消毒剂,其中氯和氧两种元素的化合价分别为
A. +2,-2B. +4,-2C. -2,+1D. -4,+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化物在冶金等行业应用广泛,含氰废水的处理显得尤为重要.含氰废水中的氰化物常以[Fe(CN)6]3﹣和CN﹣的形式存在,工业上有多种废水处理方法. 
(1)电解处理法 
图1电源废水铁电极石墨电极
用图1所示装置处理含CN﹣废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO﹣将CN﹣氧化为无害物质而除去.铁电极为(填“阴极”或“阳极”),阳极产生ClO﹣的电极反应为 .
(2)UV(紫外光线的简称)﹣H2O2氧化法. 实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2 , 置于UV工艺装置中,光照一定时间后取样分析.
【查阅资料】①在强碱性溶液中4[Fe(CN)6]3﹣+4OH﹣═4[Fe(CN)6]4﹣+O2↑+2H2O,[Fe(CN)6]4﹣更稳定;
②[Fe(CN)6]3﹣转化为CN﹣容易被H2O2除去;
③HCN是有毒的弱酸,易挥发.
Ⅰ.废水中的CN一经以下反应实现转化:CN一+H2O2+H2O═A+NH3↑,则A是(用符号表示).
Ⅱ.K3[Fe(CN)6]在中性溶液中有微弱水解,用方程式表示水解反应 .
Ⅲ.含氰废水在不同pH下的除氰效果如图2所示,pH选择的最佳范围应为(a.7﹣10;b.10﹣11;c.11﹣13),解释选择该pH范围的原因 .
Ⅳ.图3表示某pH时,加入不同量H2O2 , 处理30min后测定的样品含氰浓度.由图可知:n(H2O2):n(CN﹣)=250:1时,剩余总氰为0.16mgL﹣1 , 除氰率达80%,计算0﹣30min时间段反应速率v(CN﹣)=mgL﹣1min﹣1(结果保留两位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:
2X(g)+Y(g)2Z(g),X的转化率随时间的变化关系如图所示.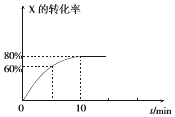
(1)第2min时的反应速率v1(X)(填“大于”、“小于”或“等于”)第8min时的反应速率可v2(X),原因是 .
(2)反应在0~10min内Y的平均反应速率v(Y)=molL﹣1min﹣l .
(3)T1℃温度下反应的平衡常数K1为 , 若在第10min后压缩容器容积,X的转化率(填“增大”、“减小”或“不变”,下同),平衡常数 .
(4)若升高温度到T2℃( T2>T1),平衡时X的转化率减小,则该反应的△H0(填“大于”或“小于”).
(5)不改变各物质起始量的情况下,无论如何改变条件,Y的转化率一定小于 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在100℃下,水的离子积KW=1×10﹣12 , 下列说法正确的是( )
A.0.05 molL﹣1 的 H2SO4 溶液 pH=1
B.0.001 molL﹣1 的 NaOH 溶液 pH=11
C.0.005 molL﹣1的H2SO4溶液与0.01 molL﹣1的NaOH溶液等体积混合,混合后溶液pH为5,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要PH=11的NaOH溶液50mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com