
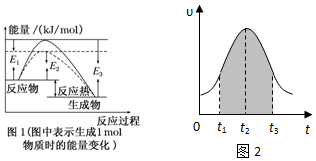
分析 (1)由图1可知反应物的总能量大于生成物的总能量,则该反应为放热反应,生成1mol氨气时放出的热量为(E3-E1)kg,然后利用化学计量数与反应热的关系并标明物质的状态来书写热化学反应方程式;
(2)由图象可知,反应速率先增大后减小,随着反应的进行,反应物浓度逐渐减小,反应中锰离子为反应的催化剂,阴影面积为浓度的变化,以此解答该题.
解答 解:(1)由图可知该反应为放热反应,且生成1mol生成物放出的热量为(E3-E1)kg,则生成2mol生成物放热为2(E3-E1)kg,即该反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-2(E3-E1)kg/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-2(E3-E1) kJ/mol;
(2)①随着反应的进行,浓度逐渐减小,但速率增大,说明反应中产生的Mn2+离子是此反应的催化剂,催化剂使反应速率增大的影响大于反应物浓度减小使反应速率减小的影响,
故答案为:反应中产生的Mn2+离子是此反应的催化剂,催化剂使反应速率增大的影响大于反应物浓度减小使反应速率减小的影响;
②随着反应的进行,反应物的浓度降低,浓度越低,反应速率越小,所以浓度的改变是反应速率变化的主要原因,
故答案为:随着反应的进行,反应物浓度逐渐减小,成为影响反应速率的主要因素,从而反应速率减小;
③根据v=$\frac{△c}{△t}$,推倒得v×△t=△C,所以阴影面积表示反应物浓度的减少或生成物浓度的增加,故选AD.
点评 本题综合考查化学反应速率以及热化学方程式,为高频考点,侧重于学生的分析、计算能力的考查,注意把握图象的分析,难度不大.


 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
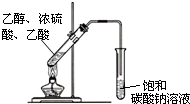 以乙烯为原料,可以制备乙酸乙酯
以乙烯为原料,可以制备乙酸乙酯查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图1所示,该晶胞中含有金属原子的数目为4.
与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图1所示,该晶胞中含有金属原子的数目为4.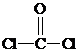 ,其中碳氧原子之间共价键是c(填序号)
,其中碳氧原子之间共价键是c(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
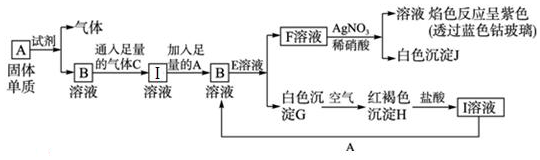
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素都可以在酸性条件下水解生成葡萄糖 | |
| B. | 煤的气化、液化和干馏都是煤综合利用的主要方法,都属于物理变化 | |
| C. | 地沟油发生皂化反应后加入饱和食盐水,搅拌发现液面上有固体物质 | |
| D. | 蛋白质溶液中加入浓的硫酸铵溶液,有固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与溴水发生加成反应而使溴水褪色 | |
| B. | 苯与溴水发生取代反应而使溴水褪色 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 苯与浓硝酸、浓硫酸的混合物发生的反应不是取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净物:水银、氢氧化铁固体、冰水混合物 | |
| B. | 碱性氧化物:Na2O、Na2O2、Al2O3 | |
| C. | 盐:纯碱、小苏打、烧碱 | |
| D. | 电解质:CH3COOH、H2O、NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com