
在一个小烧杯里加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯内加入约10 g氯化铵晶体,并立即用玻璃棒迅速搅拌。试回答下列问题:
(1)写出反应的化学方程式: _____________________________。
(2)实验中要立即用玻璃棒迅速搅拌的原因是_____________________________。
(3)如果实验中没有看到“结冰”现象,可能的原因是(答出三个或三个以上原因)__________________________ _____________。
(4)如果没有看到“结冰”现象,我们还可以采取哪些方式来说明该反应吸热?
_______________________________________(答出两种方案)。
(5)“结冰”现象说明该反应是一个________(填“放出”或“吸收”)能量的反应。即断开旧化学键________(填“吸收”或“放出”)的能量________(填“>”或“<”)形成新化学键________(填“吸收”或“放出”)的能量。
(6)该反应在常温下就可进行,说明_________________________________。
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:填空题
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) 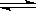 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为
。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)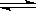 2NH3(g)反应的影响。
2NH3(g)反应的影响。
实验结果如图所示: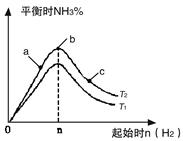
(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最高的是(填字母)。 。
③若容器容积为1L,在起始体系中加入1mol N2 ,n=3mol反应达到平衡时H2的转化率为60%,则此 条件下(T2),反应的平衡常数K= 。保持容器体积不变,再向容器中加入1mol N2,3mol H2反应达到平衡时,氢气的转化率将
(填“增大”、“减”或“不变”)。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)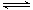 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
| t/s | 0 | 50 | 100 |
| c(N2O5)/mol·L—1 | 5.0 | 3.5 | 2.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碳和硅属于同主族元素,在生活生产中有着广泛的用途。
(1)甲烷可用作燃料电池,将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池,通入CH4的一极,其电极反应式是 ;
CH4催化还原NOX可以消除氮氧化物的污染,有望解决汽车尾气污染问题,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则NO2被甲烷还原为N2的热化学方程式为_____________________________________
(2)已知H2CO3 HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3- CO32-+H+ Ka2(HCO3-)=5.61×10-11
CO32-+H+ Ka2(HCO3-)=5.61×10-11
HA H++A- Ka(HA)=2.95×10-8
H++A- Ka(HA)=2.95×10-8
请依据以上电离平衡常数,写出少量CO2通入到NaA溶液中的离子方程式
___________________________。
(3) 在T温度时,将1.0molCO2和3.0molH2充入2L密闭恒容器中,可发生反应的方程式为CO2 (g) + 3H2(g)  CH3OH(g) + 2H2O(g) 。充分反应达到平衡后,若容器内的压强与起始压强之比为a :1,则CO2转 化率为______,当a=0.875时,该条件下此反应的平衡常数为_______________(用分数表示)。
CH3OH(g) + 2H2O(g) 。充分反应达到平衡后,若容器内的压强与起始压强之比为a :1,则CO2转 化率为______,当a=0.875时,该条件下此反应的平衡常数为_______________(用分数表示)。
(4)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英(SiO2)与焦炭在高温的氮气流中反应生成,已知该反应的平衡常数表达式K=[c(CO)]6/[c(N2)]2,若已知CO生成速率为v(CO)=6mol·L-1·min-1,则N2消耗速率为v(N2)= ;该反应的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%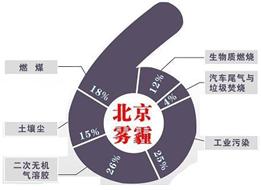
(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g)
 2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:________
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:________
| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的常用方法是升高温度 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的最佳途径是使用高效催化剂 |

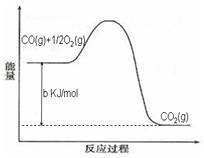
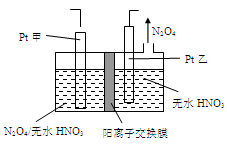
 Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示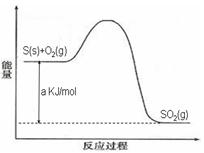
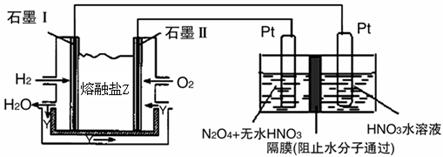
 2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________。
2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________。
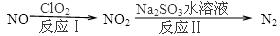
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一个小烧杯里加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯内加入约10 g氯化铵晶体,并立即用玻璃棒迅速搅拌。试回答下列问题:
(1)写出反应的化学方程式:______________。
(2)实验要立即用玻璃棒迅速搅拌的原因是_________________。
(3)如果实验中没有看到“结冰”现象,可能的原因是__________________________(答出三个或三个以上原因)。
(4)如果没有看到“结冰”现象,我们还可以采取哪些方式来说明该反应吸热?__________________________________________________________________________________________(答出两种方案)。
(5)“结冰”现象说明反应是一个________(填“放出”或“吸收”)能量的反应,即断开旧化学键________(填“放出”或“吸收”)能量____________(填“>”或“<”)形成新化学键________(填“吸收”或“放出”)的能量。
(6)该反应在常温下就可以进行,说明______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题: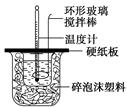
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热____________(填“偏大”、“偏小”或“不变”)。
(2)在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会____________(填“偏大”、“偏小”或“不变”)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会____________(填“偏大”、“偏小”或“不变”),其原因是_______________________________________________。
(4)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
 ”表示硅晶体中的一个原子,请在立方体的顶点用“
”表示硅晶体中的一个原子,请在立方体的顶点用“ ”表示出与之紧邻的硅原子。
”表示出与之紧邻的硅原子。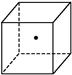
 Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。
Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如下图所示:
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程和能量关系可用下图简单表示(图中的ΔH表示生成1 mol产物的数据)。
(1)写出表示S8燃烧热的热化学方程式___________________________________。
(2)写出SO3分解生成SO2和O2的热化学方程式_______________________________________________________________。
(3)化学上规定,拆开或形成1 mol化学键吸收或放出的能量称为该化学键的键能,单位kJ·mol。若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,则S8分子中硫硫键的键能为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效减碳的手段之一是节能,下列制氢方法最节能的是 。
A.电解水制氢:2H2O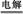 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O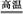 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O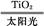 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O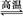 CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH="-49.0" kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH="-49.0" kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。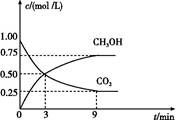
①从3 min到9 min,v(H2)= mol/(L·min)。
②能说明上述反应达到平衡状态的是 (填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×1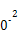 | 2.4×1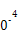 | 1×1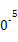 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com