
(22分) I.下图中A、B、C、D、E、F、G均为有机化合物。

根据上图回答问题:
(1)D的化学名称是_____________;B的结构简式是______________________;
(2)反应④的化学方程式是___________________________________________;
(3)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途。________________________________________________________________。
II. 一种高分子化合物(Ⅵ)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):
回答下列问题:
(1)目前工业上生产乙烯主要是以石油为原料通过________反应来实现。
(2)化合物Ⅲ生成化合物Ⅳ的副产物为________________________;
(3)写出合成路线中从化合物Ⅳ到化合物Ⅴ的反应方程式:
___________________________________________________________________;
(4)下列关于化合物Ⅲ、Ⅳ和Ⅴ的说法中,正确的是 ____________(填字母)。
A.化合物Ⅲ可以发生氧化反应 B.化合物Ⅳ和Ⅴ均可以使溴的四氯化碳溶液褪色
C.化合物Ⅳ能与氢气发生加成反应 D.化合物Ⅴ可以发生水解反应
E化合物Ⅲ、Ⅳ和Ⅴ均可与金属钠反应生成氢气 F.化合物Ⅲ不可以与NaOH 溶液反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(每空2分,共22分)
I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L · s)]与反应时间t(s)的关系如图所示。回答如下问题:
(1)该反应的化学方程式:
(2)0→t2时间段内反应速率增大的原因是: ,
(3)t2→t时间段内反应速率减小的原因是: ,
(4)图中阴影部分“面积”表示t1→t3时间里 。
A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42-物质的量浓度 D.MnO4-物质的量浓度的减小
II. 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如上图甲可观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如上图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的数据是
(3)加入0.01mol MnO2粉末于60mL H2O2溶液中,在标准状况下放出气体体积和时间的关系如图所示。设放出气体的总体积为V mL。
①放出V/3 mL气体时所需时间为 min。
② 该H2O2溶液的浓度为
③A、B、C、D各点反应速率快慢的顺序为 > > >
查看答案和解析>>
科目:高中化学 来源:河北省冀州中学10-11学年高一下学期期末考试(化学理)B卷 题型:实验题
(每空2分,共22分)
I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L · s)]与反应时间t(s)的关系如图所示。回答如下问题: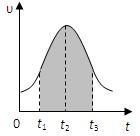
(1)该反应的化学方程式:
(2)0→t2时间段内反应速率增大的原因是: ,
(3)t2→t时间段内反应速率减小的原因是: ,
(4)图中阴影部分“面积”表示t1→t3时间里 。
A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42-物质的量浓度 D.MnO4-物质的量浓度的减小
II.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如上图甲可观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如上图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的数据是
(3)加入0.01mol MnO2粉末于60mL H2O2溶液中,在标准状况下放出气体体积和时间的关系如图所示。设放出气体的总体积为V mL。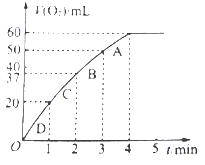
①放出V/3 mL气体时所需时间为 min。
②该H2O2溶液的浓度为
③A、B、C、D各点反应速率快慢的顺序为 > > >
查看答案和解析>>
科目:高中化学 来源:2010—2011学年广东省惠阳高级中学高二上学期期末考试化学试卷 题型:填空题
(22分) I.下图中A、B、C、D、E、F、G均为有机化合物。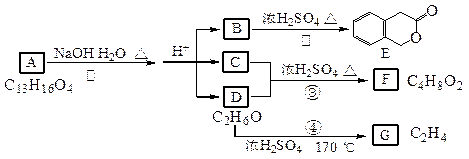
根据上图回答问题:
(1)D的化学名称是_____________;B的结构简式是_______ _______________;
_______________;
(2)反应④的化学方程式是_________________ __________________________;
__________________________;
(3)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途。________________________________________________________________。
II. 一种高分子化合物(Ⅵ)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):
回答下列问题:
(1)目前工业上生产乙烯主要是以石油为原料通过________反应来实现。
(2)化合物Ⅲ生成化合物Ⅳ的副产物为________________________;
(3)写出合成路线中从化合物Ⅳ到化合物Ⅴ的反应方程式:
___________________________________________________________________;
(4)下列关于化合物Ⅲ、Ⅳ和Ⅴ的说法中,正 确的是 __
确的是 __ __________(填字母)。
__________(填字母)。
A.化合物Ⅲ可以发生氧化反应 B.化合物Ⅳ和Ⅴ均可以使溴的四氯化碳溶液褪色
C.化合物Ⅳ能与氢气发生加成反应 D.化合物Ⅴ可以发生水解反应
E化合物Ⅲ、Ⅳ和Ⅴ均可与金属钠反应生成氢气 F.化合物Ⅲ不可以与NaOH 溶液反应
查看答案和解析>>
科目:高中化学 来源:河北省10-11学年高一下学期期末考试(化学理)B卷 题型:实验题
(每空2分,共22分)
I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L · s)]与反应时间t(s)的关系如图所示。回答如下问题:

(1)该反应的化学方程式:
(2)0→t2时间段内反应速率增大的原因是: ,
(3)t2→t时间段内反应速率减小的原因是: ,
(4)图中阴影部分“面积”表示t1→t3时间里 。
A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42-物质的量浓度 D.MnO4-物质的量浓度的减小
II. 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验。请回答相关问题:
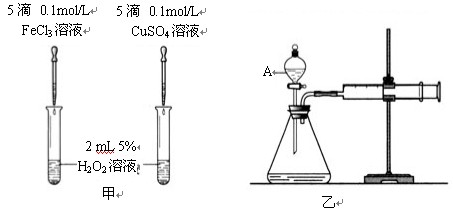
(1)定性分析:如上图甲可观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如上图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的数据是
(3)加入0.01mol MnO2粉末于60mL H2O2溶液中,在标准状况下放出气体体积和时间的关系如图所示。设放出气体的总体积为V mL。
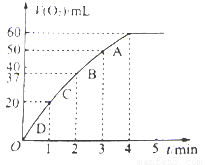
①放出V/3 mL气体时所需时间为 min。
② 该H2O2溶液的浓度为
③A、B、C、D各点反应速率快慢的顺序为 > > >
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com