

分析 (1)氢氧燃料电池中,原电池工作时,氢氧燃料电池的总反应为2H2+O2=2H2O;通入氢气的一极a为电源的负极,发生氧化反应,通入氧气的一极b为原电池的正极,发生还原反应;
(2)①燃料电池中通氧气的是正极,通燃料的是负极,和正极相连的是阳极,和负极相连的是阴极;
②燃料电池中燃料失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水;B电极与原电池负极相连,为阴极,银离子在B上得电子;
③乙为电解池,电解质溶液为AgNO3,根据电解池的工作原理来回答;
④根据电极方程式计算.
解答 解:(1)氢氧燃料电池中,通入氢气的一极为电源的负极,通入氧气的一极为原电池的正极,由于电解质溶液呈碱性,则负极电极反应式为:2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O),正极电极反应式为:O2+4e-+2H2O=4OH-,
故答案为:负;正;2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O);O2+4e-+2H2O=4OH-;
(2)①甲装置是燃料电池,属于原电池,其中通氧气的是正极,通燃料的是负极,和正极相连的是阳极,和负极相连的是阴极,所以石墨电极的名称是阳极,故答案为:原电池;阳极;
②燃料电池中燃料失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,其电极的电极反应式是CH3OH-6e-+8OH-═6H2O+CO32-;B电极与原电池负极相连,为阴极,银离子在B上得电子,其电极方程式为:Ag++e-=Ag;
故答案为:CH3OH-6e-+8OH-═6H2O+CO32-;Ag++e-=Ag;
③乙为电解池,电解质溶液为AgNO3,则乙池中反应的化学方程式为4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,
故答案为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3;
③乙池中A(Ag)极上银离子得电子生成Ag,其电极反应为Ag++e-=Ag,已知A(Ag)极的质量增加5.40g时,n(Ag)=0.05mol,则转移电子为0.05mol,
故答案为:0.05.
点评 本题考查了原电池和电解池原理,明确离子放电顺序是解本题关键,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水可用来鉴别Na2CO3和NaHCO3溶液 | |
| B. | 能使湿润的碘化钾淀粉试纸变蓝的物质一定是氯气 | |
| C. | NO2、CO2和SO2溶于水均可导电,它们都是电解质 | |
| D. | 将SO2通入酸化的Ba(NO3)2溶液中会出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NH4+、Al3+、H+ | B. | Fe2+、Al3+、Na+、H+ | ||
| C. | Na+、Fe3+、Al3+、H+ | D. | Ag+、Fe3+、Na+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释0.1mol•L-1 CH3COOH溶液时,溶液中所有离子浓度均减小 | |
| B. | 对FeCl3溶液进行稀释时,Fe3+的水解程度增大,故溶液的酸性增强 | |
| C. | 可根据难溶电解质Ksp的数值大小直接比较难溶电解质在水中的溶解度大小 | |
| D. | 25℃时,Ksp(AgCl)>Ksp(AgI),向AgCl悬浊液中加入KI固体,有黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于15% | B. | 大于15% | C. | 小于15% | D. | 无法估计 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 金元素属于非金属元素 | B. | 金元素所有原子的质子数都为79 | ||
| C. | 金元素所有原子的中子数都为79 | D. | 金元素所有原子的中子数都为197 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.023mol/L | B. | 0.045mol/L | C. | 0.45mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
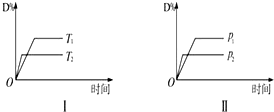 对于可逆反应mA(g)+nB(s)?pC(g)+qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是( )
对于可逆反应mA(g)+nB(s)?pC(g)+qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是( )| A. | 升高温度,平衡正移 | |
| B. | 使用催化剂,D的百分含量增加 | |
| C. | m<p+q | |
| D. | B的颗粒越小,反应速率越快,有利于平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com