

| A. | 发生腐蚀过程中,电子从接头流向水表 | |
| B. | 腐蚀时,铁接头发生的是还原反应 | |
| C. | 腐蚀时铜质水表发生的电极反应为:2H2O+O2+4e-═4OH- | |
| D. | 腐蚀过程还涉及到反应:4Fe(OH)2+2H2O+O2═4Fe(OH)3 |
分析 A、构成原电池,铁活泼为负极,保护铜,电子由铁流向铜;
B、构成原电池,铁活泼为负极发生氧化反应;
C、水表发生了吸氧腐蚀,氧气在水表的表面得电子,电极反应式为:2H2O+O2+4e-=4OH-;
D、负极放电产生的亚铁离子与正极产生氢氧根离子结合成氢氧化亚铁,氢氧化亚铁被空气中的氧气氧化生成氢氧化铁
解答 解:A、构成原电池,铁活泼为负极,保护铜,电子由铁流向铜即接头流向水表,故A正确;
B、构成原电池,铁活泼为负极发生氧化反应,故B错误;
C、水表发生了吸氧腐蚀,氧气在水表的表面得电子,电极反应式为:2H2O+O2+4e-=4OH-,故C正确;
D、负极放电产生的亚铁离子与正极产生氢氧根离子结合成氢氧化亚铁,氢氧化亚铁被空气中的氧气氧化生成氢氧化铁,所以腐蚀过程还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3,故D正确;
故选B.
点评 本题考查了电化学腐蚀的原理,难度不大,明确正负极的判断、电子的流向、电极反应式即可解答.


科目:高中化学 来源: 题型:选择题
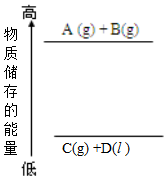
| A. | A(g)+B(g)→C(g)+D(l)+Q | |
| B. | A(g)+B(g)→C(g)+D(l)-Q | |
| C. | C(g)+D(l)→A(g)+B(g)+Q | |
| D. | C(g)+D(l)具有的能量大于A(g)+B(g)具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si可用来制造半导体材料 | |
| B. | 用丁达尔效应可以鉴别溶液和胶体 | |
| C. | 铁制容器可用于常温下贮存、运输浓硫酸 | |
| D. | SO3溶于水形成的溶液能导电,所以SO3是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 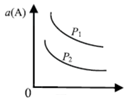 图:p1>p2,则此反应只能在高温下自发进行 | |
| B. |  图:此反应的△H<0,且T1<T2 | |
| C. |  图:表示t1时刻一定是使用催化剂对反应速率的影响 | |
| D. |  图:表示t1时刻增大B的浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | 铜加入稀硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 向AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 澄清石灰水与过量NaHCO3溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{4}{5}$ v(NH3)=v(O2) | B. | $\frac{4}{5}$ v(O2)=v(NO) | C. | $\frac{5}{6}$ v(O2)=v(H2O) | D. | $\frac{2}{3}$ v(NH3)=v(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
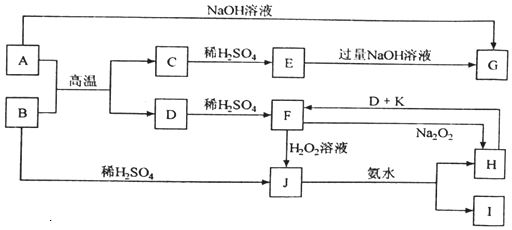
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com