
【题目】A是一种重要的化工原料,部分性质及转化关系如图:
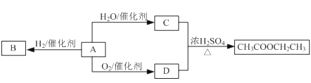
请回答:
(1)产物E的名称是______________________
(2)A→D的反应类型是________
A.取代反应B.加成反应C.氧化反应D.还原反应
(3)写出A→C反应的化学方程式______________________________________________
(4)某烃X与B是同系物,分子中碳与氢的质量比为36:7,化学性质与甲烷相似。现取两支试管,分别加入适量溴水,实验操作及现象如下:
有关X的说法正确的是____________
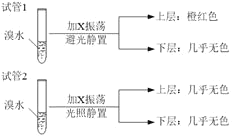
A.相同条件下,X的密度比水小
B.X的同分异构体共有6种
C.X能与Br2发生加成反应使溴水褪色
D.试验后试管2中的有机层是上层还是下层,可通过加水确定
【答案】乙酸乙酯 C ![]() AD。
AD。
【解析】
C与D反应生成乙酸乙酯,则C、D分别为乙酸、乙醇中的一种,A与水反应生成C,A氧化生成D,且A与氢气发生加成反应生成B,可推知A为CH2=CH2,与水在一定条件下发生加成反应生成C为CH3CH2OH,乙烯氧化生成D为CH3COOH,乙烯与氢气发生加成反应生成B为CH3CH3。
(1)C与D反应生成E,E为乙酸乙酯,故答案为:乙酸乙酯;
(2)A→D是CH2=CH2被氧气氧化生成D为CH3COOH,反应类型为氧化反应,选C,故答案为:C;
(3)A→C是CH2=CH2与水在一定条件下发生加成反应生成C为CH3CH2OH,其化学反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)某烃X与B是同系物,分子中碳与氢的质量比为36:7,则C、H原子数目之比为![]() ,所以X为C6H14。
,所以X为C6H14。
A.相同条件下,C6H14的密度比水小,A正确;
B.C6H14的同分异构体共有己烷、2-甲基戊烷、3-甲基戊烷、2,3-二甲基丁烷、2,2-二甲基丁烷,共5种,B错误;
C.C6H14为烷烃,不能与Br2发生加成反应使溴水褪色,C错误;
D.发生取代反应得到溴代烃,与水不互溶,可以通过加水确定试管2中的有机层是上层还是下层,D正确;故答案为:AD。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】已知元素周期表中共有18个纵行,下图实线表示元素周期表的边界。按核外电子排布,可把元素周期表里的元素划分为![]() 区、
区、![]() 区、
区、![]() 区、
区、![]() 区等。除
区等。除![]() 区外,其他区的名称来自按构造原理最后填入电子的能级的符号。
区外,其他区的名称来自按构造原理最后填入电子的能级的符号。
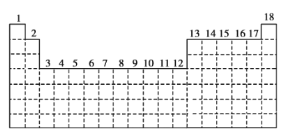
(1)请在上图中用实线画出![]() 区、
区、![]() 区、
区、![]() 区、
区、![]() 区的边界线,并分别用阴影
区的边界线,并分别用阴影![]() 和
和![]() 表示
表示![]() 区和
区和![]() 区________。
区________。
(2)有的同学受这种划分的启发,认为![]() 区内第6、7纵行的部分元素可以排在另一区,你认为应排在______区。
区内第6、7纵行的部分元素可以排在另一区,你认为应排在______区。
(3)请在上述元素周期表中用元素符号标出![]() 轨道处于半充满状态的元素________。
轨道处于半充满状态的元素________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M的名称是乙烯雌酚,它是一种激素类药物,结构简式如下。下列叙述不正确的是
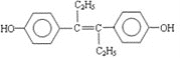
A.M属于芳香族化合物
B.M可与NaOH溶液或NaHCO3溶液发生反应
C.1molM最多能与7molH2发生加成反应
D.1molM与饱和溴水混合,最多消耗5molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃的结构简式为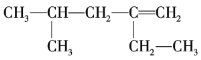 ,甲、乙、丙、丁四位同学分别将其命名为2-甲基-4-乙基-4-戊烯、2-异丁基-1-丁烯、2,4-二甲基-3-己烯、4-甲基-2-乙基-1-戊烯。下列对四位同学的命名判断正确的是( )
,甲、乙、丙、丁四位同学分别将其命名为2-甲基-4-乙基-4-戊烯、2-异丁基-1-丁烯、2,4-二甲基-3-己烯、4-甲基-2-乙基-1-戊烯。下列对四位同学的命名判断正确的是( )
A.甲的命名中对主链的选择是错误的B.乙的命名中对主链碳原子的编号是错误的
C.丙的命名中对主链的选择是正确的D.丁的命名是正确的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃A,其蒸气密度是相同状况下氢气密度的64倍,经测定得知A分子中共含有6个甲基。
(1)若A不是烯烃与氢气加成的产物,则A的结构简式为:__________________________;
(2)若A是炔烃与氢气加成的产物,则A的名称为:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物在自然界中数目非常庞大,对此你认为下列解释不合理的是( )
A.碳原子能与其他原子形成四个共价键
B.有机化合物存在同分异构现象
C.碳是非金属元素
D.碳原子能与![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等多种非金属原子形成共价化合物,且原子连接方式多样
等多种非金属原子形成共价化合物,且原子连接方式多样
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列有机化合物的说法正确的是( )
A.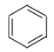 、
、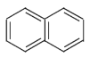 、
、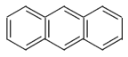 互为同系物
互为同系物
B.有机化合物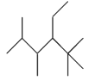 的名称是2,3,5,5-四甲基-4-乙基己烷
的名称是2,3,5,5-四甲基-4-乙基己烷
C.有机化合物![]() 中最多有16个原子共面
中最多有16个原子共面
D.有机化合物![]() 的分子式为
的分子式为![]() ,且能与
,且能与![]() 溶液反应产生
溶液反应产生![]() ,其同分异构体有8种
,其同分异构体有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:
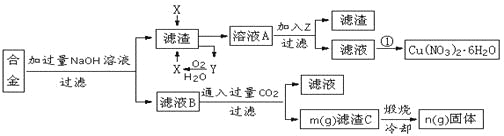
已知:
Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7
回答下列问题:
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式_______________________。试剂X的名称为______________。
(2)加入Z的作用是调节溶液的pH,pH范围应为_____;下列可作为试剂Z的是_______。
a.铜粉 b.氨水 c.氧化铜 d.硫酸铜
(3)实验操作①依次是_________、_________、过滤洗涤即可得硝酸铜晶体。
(4)测定硝酸铜晶体的结晶水含量,下列方案中肯定不可行的是______。(选填编号)
a.称量样品→加热→冷却→称量CuO
b.称量样品→加热→冷却→称量Cu(NO3)2
c.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
d.称量样品→加过量已知量的NaOH溶液→选用酚酞指示剂用标准盐酸滴定
(5)根据流程图内数据计算:滤渣C中氢氧化铝的质量分数为______________________。(用m、n的代数式表示)
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高的可能性是最大的,原因有_______________________________;____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com