
| A. | KCN 与KOCN中氮元素的化合价均为-3价 | |
| B. | 氰酸盐被氧化过程中氮和碳的化合价均升高 | |
| C. | 氰酸盐进一步被氧化的产物之一是无毒的N2 | |
| D. | 完全处理含0.1 mol CN-的废水,理论上需要消耗Cl2的体积为5.6L(标准状况下) |
分析 A.在KCN与KOCN中,氮元素都呈负价;
B.反应中只有C、Cl元素的化合价发生变化;
C.含氮的无毒气体为氮气;
D.根据氧化还原反应得失电子守恒计算.
解答 解:A.在KCN与KOCN中,氮元素都呈负价,又氮元素负价只有-3价,所以在KCN与KOCN中氮元素的化合价均为-3价,故A正确;
B.反应中只有C、Cl元素的化合价发生变化,其中C的化合价升高,Cl的化合价降低,故B错误;
C.含氮的无毒气体为氮气,所以氰酸盐进一步被氧化的产物之一是无毒的氮气,故C正确;
D.有题意CN-最终被氯气氧化成氮气和二氧化碳,所以1molCN-被氧化化合价升高2+3=5,所以氯气化合价也降低5价即消耗2.5mol,所以完全处理含0.1molCN-的废水,理论上需要消耗Cl2的体积为0.25mol×22.4L/mol=5.6L,故D正确;
故选B.
点评 本题考查氧化还原反应,注意从化合价的角度分析,正确判断反应中各元素的化合价是做本题的关键,题目难度不大.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
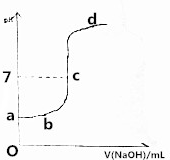 在研究弱电解质的电离、盐类的水解和溶液中离子浓度大小比较中,某师生共同做了这样一个实验:常温下,向20.0mL,0.1mol/LCH3COOH溶液中逐滴加入0.01mol/L的NaOH溶液,并在滴加过程中不断用pH计测量混合溶液的pH,绘出pH-V(NaOH)图象,如图所示.请分析:
在研究弱电解质的电离、盐类的水解和溶液中离子浓度大小比较中,某师生共同做了这样一个实验:常温下,向20.0mL,0.1mol/LCH3COOH溶液中逐滴加入0.01mol/L的NaOH溶液,并在滴加过程中不断用pH计测量混合溶液的pH,绘出pH-V(NaOH)图象,如图所示.请分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40 g NaOH溶于1 L水所得的溶液 | |
| B. | 将22.4 L HCl溶于水配成1 L溶液 | |
| C. | 1 L含2 mol K+的K2SO4溶液 | |
| D. | 将0.5 mol•L-1的NaNO3溶液100 mL加热蒸发掉50 g 水后的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NH4HSO4固体,v(H2)不变 | B. | 加入少量硫酸钠溶液,v(H2)减小 | ||
| C. | 加入CH3COONa固体,v(H2)不变 | D. | 滴加少量CuSO4溶液,v(H2)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
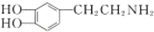 是一种重要的中枢神经传导物质,是用来帮助细胞传送脉冲的化学物质,能影响人对事物的欢愉感受,多巴胺可由D(香兰素)与硝基甲烷反应后再经锌汞齐还原水解制得.合成过程如图所示:
是一种重要的中枢神经传导物质,是用来帮助细胞传送脉冲的化学物质,能影响人对事物的欢愉感受,多巴胺可由D(香兰素)与硝基甲烷反应后再经锌汞齐还原水解制得.合成过程如图所示:
 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$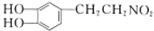 .
.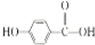 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:Br->Fe2+>I- | B. | 还原性:I->Fe2+>Br- | ||
| C. | 氧化性:Br2>I2>Fe3+ | D. | 氧化性:I2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
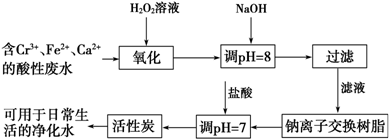
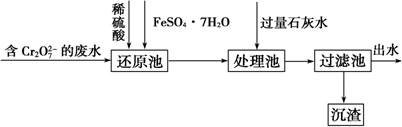
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com