
| 操作 | 现象 | |
| A | 加入NaOH溶液 | 有红褐色沉淀 |
| B | 加入Ba(NO3)2溶液 | 有白色沉淀 |
| C | 加入酸性KMnO4溶液 | 紫色褪去 |
| D | 加入K3[Fe(CN)6](铁氰化钾)溶液 | 有蓝色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 SO2与FeCl3溶液发生氧化还原反应则三价铁离子反应生成二价铁,过程中有化合价变化,据此判断解答.
解答 解:A.将一定量的SO2通入FeCl3溶液中,加入NaOH溶液有红褐色沉淀生成氢氧化铁沉淀,过程中没有化合价变化,不是氧化还原反应,故A错误;
B.加入Ba(NO3)2溶液,有白色沉淀,硝酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子,硫酸根与钡离子反应生成硫酸钡沉淀,即使二氧化硫与三价铁离子不发生氧化还原反应,也可产生白色沉淀,所以不能证明SO2与FeCl3溶液发生氧化还原反应,故B错误;
C.加入酸性KMnO4溶液,紫色退去,因为二氧化硫具有还原性能够还原酸性高锰酸钾,即使二氧化硫与三价铁离子不发生氧化还原反应,也可使其溶液褪色,所以不能证明SO2与FeCl3溶液发生氧化还原反应,故C错误;
D.亚铁离子加入K3[Fe(CN)6](铁氰化钾)溶液生成Fe3[Fe(CN)6]2↓(蓝色沉淀),则可证明溶液中存在二价铁离子,说明SO2与FeCl3溶液发生氧化还原反应,故D正确;
故选:D.
点评 本题考查了元素化合物知识,明确二氧化硫的性质是解题关键,注意二价铁离子的检验,题目难度中等.


科目:高中化学 来源: 题型:解答题
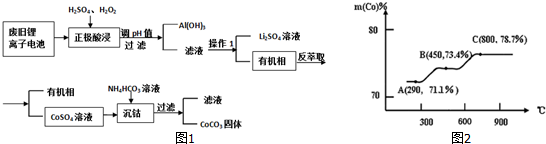
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
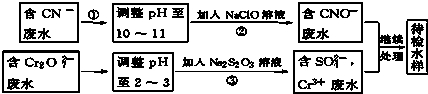
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
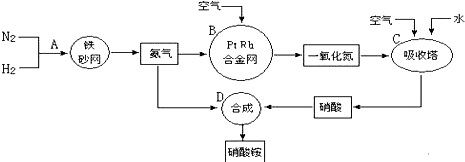
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
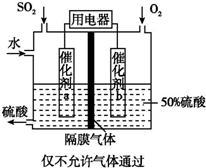 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com