
| A. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═-+4NH4+ | |
| B. | 铅酸蓄电池充电时的正极反应:PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| C. | Fe2(SO4)3溶液与Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O |
分析 A.不符合反应客观事实;
B.电解池充电,阳极发生氧化反应;
C.1mol二价铁离子对应3mol硫酸根离子,消耗3mol氢氧化钡;
D.氢氧化钠过量,氨根离子、二价铁离子都参与反应.
解答 解:A.向Al2(SO4)3溶液中加入过量NH3•H2O,反应生成氢氧化铝沉淀和硫酸铵,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A错误;
B.铅酸蓄电池充电时的阳极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42-,故B错误;
C.Fe2(SO4)3和Ba(OH)2溶液混合,离子方程式:2Fe3++3SO42-+3Ba2++6OH-═2Fe(OH)3↓+3BaSO4↓,故C错误;
D.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应,离子方程式:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,涉及电解池电极反应式书写,明确反应实质是解题关键,注意充电池时为电解池,电解池阳极发生氧化反应,阴极发生还原反应,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  蒸馏水 | B. | 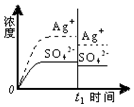 0.010mol•L-1 Ag2SO4溶液 | ||
| C. | 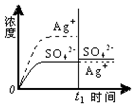 0.020mol•L-1 Na2SO4溶液 | D. | 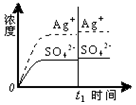 0.040mol•L-1 AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的摩尔质量等于其相对原子质量或相对分子质量 | |
| B. | 摩尔是7个基本物理量之一 | |
| C. | 46 g NO2和N2O4的混合物中含有的氮原子数为NA | |
| D. | 1molCO2所占的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失 | |
| B. | 在加入铝粉能放出氢气的溶液中:K+、NH4+、NO3-、Cl-一定能够大量共存 | |
| C. | 利用食醋除去热水瓶水垢中CaCO3的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 除去乙酸乙酯中的少量乙酸:加入过量的NaOH溶液,静置分层后,除去水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S的燃烧热为297KJ/mol | |
| B. | 1mol硫蒸气完全燃烧放出的热量大于297KJ | |
| C. | 1mol硫蒸气完全燃烧放出的热量小于297KJ | |
| D. | 形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S H2 CO2 | B. | SO2 Cl2 H2S | ||
| C. | O2 SO2 Cl2 | D. | HCl Cl2 SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
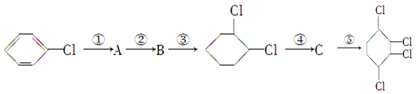
 ,B:
,B: ,C:
,C: .
. +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaCl+H2O.
+NaCl+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com