

 的邻位异构体分子内脱水产物,香豆素的结构简式为
的邻位异构体分子内脱水产物,香豆素的结构简式为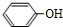 ,与HCHO发生加成反应生成
,与HCHO发生加成反应生成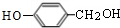 ,结合B的分子式可知,反应②为醇的氧化反应,B为
,结合B的分子式可知,反应②为醇的氧化反应,B为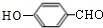 ,结合反应①可知,
,结合反应①可知, 与乙醛发生加成反应,再发生消去反应得到
与乙醛发生加成反应,再发生消去反应得到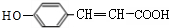 ,结合M的结构简式与C的分子式可知,
,结合M的结构简式与C的分子式可知,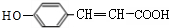 中碳碳双键与氢气发生加成反应生成C为
中碳碳双键与氢气发生加成反应生成C为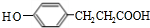 ,结合M的结构简式与D的分子式可知,C与据此发生酯化反应生成D为
,结合M的结构简式与D的分子式可知,C与据此发生酯化反应生成D为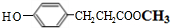 ,由(5)可知,D中酚羟基与碳酸钠反应得到酚Na,再与E发生取代反应得到M,M可以为
,由(5)可知,D中酚羟基与碳酸钠反应得到酚Na,再与E发生取代反应得到M,M可以为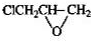 ,据此解答.
,据此解答. ,与HCHO发生加成反应生成
,与HCHO发生加成反应生成 ,结合B的分子式可知,反应②为醇的氧化反应,B为
,结合B的分子式可知,反应②为醇的氧化反应,B为 ,结合反应①可知,
,结合反应①可知, 与乙醛发生加成反应,再发生消去反应得到
与乙醛发生加成反应,再发生消去反应得到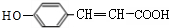 ,结合M的结构简式与C的分子式可知,
,结合M的结构简式与C的分子式可知,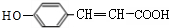 中碳碳双键与氢气发生加成反应生成C为
中碳碳双键与氢气发生加成反应生成C为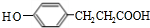 ,结合M的结构简式与D的分子式可知,C与据此发生酯化反应生成D为
,结合M的结构简式与D的分子式可知,C与据此发生酯化反应生成D为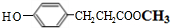 ,由(5)可知,D中酚羟基与碳酸钠反应得到酚Na,再与E发生取代反应得到M,M可以为
,由(5)可知,D中酚羟基与碳酸钠反应得到酚Na,再与E发生取代反应得到M,M可以为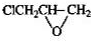 ,
, ,含氧官能团名称是羟基,反应②的反应类型是氧化反应,故答案为:羟基;氧化反应;
,含氧官能团名称是羟基,反应②的反应类型是氧化反应,故答案为:羟基;氧化反应;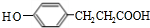 ,
,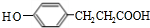 ;
; 的邻位异构体分子内脱水产物,香豆素的结构简式为:
的邻位异构体分子内脱水产物,香豆素的结构简式为: ,故答案为:
,故答案为: ;
;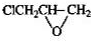 ,由D生成M的有关化学反应方程式为:
,由D生成M的有关化学反应方程式为: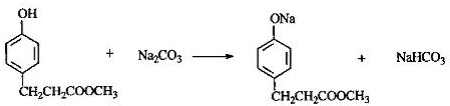 、
、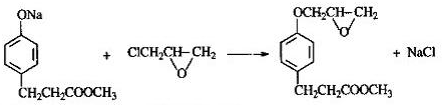 ,
, ;
; .
.


科目:高中化学 来源: 题型:
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 1.20 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X-、Y-、Z-、W-中Z-的还原性最强 |
| B、X2、Y2、Z2、W2中Z2的氧化性最弱 |
| C、2Z-+Y2═2Y-+Z2不能向右进行 |
| D、还原性X->Y- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在稀氨水中滴加AgNO3溶液来配制银氨溶液,银氨溶液久置容易爆炸,要随配随用 |
| B、用标准NaOH溶液测定食醋中醋酸含量时应该使用酚酞作为指示剂 |
| C、将饱和氯水滴到淀粉碘化钾试纸上,如果试纸先变蓝后变白,说明氯水具有强氧化性 |
| D、重结晶法提纯KNO3产品除去少量NaCl时,应在较高温度下溶解产品配成浓溶液后冷却结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 一系列 |
| 操作 |
| ①酸性高锰酸钾 |
| ②(NH4)2Fe(SO4)2 |
| 标准溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若生成1 molP(g),则放出的热量等于a kJ |
| B、若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| C、若升高温度,正反应速率加快,逆反应速率减慢,化学平衡正向移动 |
| D、达到化学平衡状态时,若c(Y)=0.100mol/L,则c(P)=0.0203 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com