
【题目】设![]() 为阿伏伽德罗常数的值.下列说法正确的是( )
为阿伏伽德罗常数的值.下列说法正确的是( )
A.2L![]() 亚硫酸溶液中含有的
亚硫酸溶液中含有的![]() 离子数为
离子数为![]()
B.室温下,1L![]() 的NaOH溶液中,由水电离的
的NaOH溶液中,由水电离的![]() 离子数目为
离子数目为![]()
C.标准状况下,46g![]() 气体的分子数为
气体的分子数为![]()
D.某密闭容器中盛有![]()
![]() 和
和![]()
![]() ,在一定条件下充分反应,转移电子的数目小于
,在一定条件下充分反应,转移电子的数目小于![]()
【答案】D
【解析】
A、亚硫酸是弱酸,不能完全电离;
B、![]() 的氢氧化钠溶液中,氢离子全部来自于水的电离;
的氢氧化钠溶液中,氢离子全部来自于水的电离;
C、46g ![]() 的物质的量为1mol,而二氧化氮中存在平衡:
的物质的量为1mol,而二氧化氮中存在平衡:![]() ;
;
D、合成氨的反应为可逆反应。
A、亚硫酸是弱酸,不能完全电离,故溶液中的氢离子的个数小于![]() 个,故A错误;
个,故A错误;
B、![]() 的氢氧化钠溶液中,氢氧根浓度为
的氢氧化钠溶液中,氢氧根浓度为![]() ,几乎全部来自氢氧化钠的电离,而氢离子的浓度为
,几乎全部来自氢氧化钠的电离,而氢离子的浓度为![]() 全部来自水的电离,由于水电离出的氢离子浓度和氢氧根的浓度相同,故此溶液中水电离出的氢氧根的浓度也为
全部来自水的电离,由于水电离出的氢离子浓度和氢氧根的浓度相同,故此溶液中水电离出的氢氧根的浓度也为![]() ,则物质的量为
,则物质的量为![]() ,个数为
,个数为![]() 个,故B错误;
个,故B错误;
C、46g ![]() 的物质的量为1mol,而中存在平衡:
的物质的量为1mol,而中存在平衡:![]() ,则导致分子个数减少,故分子个数小于
,则导致分子个数减少,故分子个数小于![]() 个,故C错误;
个,故C错误;
D、合成氨的反应为可逆反应,不能进行彻底,则转移的电子数小于![]() 个,故D正确;
个,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】塑化剂主要用作塑料的增塑剂,也可作为农药载体、驱虫剂和化妆品等的原料。添加塑化剂(DBP)可改善白酒等饮料的口感,但超过规定的限量会对人体产生伤害。其合成线路图如图I所示: 已知以下信息:
①
②R1CHO+R2CH2CHO +H2O
+H2O
③C为含两个碳原子的烃的含氧衍生物,其核磁共振氢谱图如图所示

请根据以上信息回答下列问题:
(1)C的结构简式为____________, E中所含官能团的名称是____________;
(2)写出下列有关反应的化学方程式:
①E和H2以物质的量比1︰1反应生成F:______________________;
②B和F以物质的量比1︰2合成DBP:_____________________,该反应的反应类型为_____________________。
(3)同时符合下列条件的B的同分异构体有______种,写出其中任意两种同分异构体的结构简式_________________。
①不能和NaHCO3溶液反应 ②能发生银镜反应
③遇FeCl3溶液显紫色 ④核磁共振氢谱显示苯环上只有一种氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,混合溶液的pH随KOH溶液的加入变化情况如图,下列结论错误的是( )
溶液,混合溶液的pH随KOH溶液的加入变化情况如图,下列结论错误的是( )

A.当加入![]() mLKOH溶液时,所得溶液中水的电离程度大于X点溶液的水的电离程度
mLKOH溶液时,所得溶液中水的电离程度大于X点溶液的水的电离程度
B.HA为弱酸,常温下,Ka的数量级为![]()
C.Y点对应的溶液中:![]()
D.若用KOH溶液滴定HA溶液,可选用甲基橙作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 下,弱电解质的电离平衡常数
下,弱电解质的电离平衡常数![]() ,下列说法正确的是
,下列说法正确的是
A.用![]() 的盐酸滴定
的盐酸滴定![]() 的氨水时,可用酚酞作指示剂
的氨水时,可用酚酞作指示剂
B.![]() 的醋酸与
的醋酸与![]() 的氢氧化钠溶液等体积混合,所得溶液中:
的氢氧化钠溶液等体积混合,所得溶液中:![]()
C.pH相同的![]() 、
、![]() 的两种溶液的
的两种溶液的![]() :
:![]()
D.![]() 的醋酸与
的醋酸与![]() 的氨水等体积混合,所得溶液中由水电离出的
的氨水等体积混合,所得溶液中由水电离出的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列实验现象的说法不正确的是
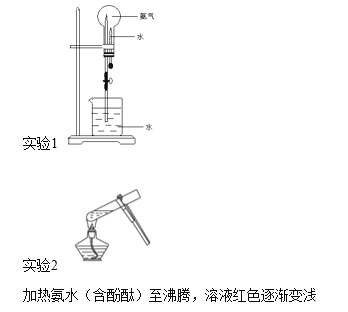
A. 氨气是无色有刺激性气味的气体,密度比空气小
B. 实验1,由喷泉现象可知氨气极易溶于水且溶解速率快
C. 实验1,烧瓶溶液中的含氮微粒有:NH3、NH3·H2O和NH4+
D. 实验2,加热过程中温度和c(NH3·H2O)对NH3·H2O电离平衡移动方向的影响一致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌、硫化锌都是重要的基础化工原料。
(1)ZnO 与 Al2O3 的化学性质相似,ZnO 在 NaOH 溶液中转化成[Zn(OH)4]2的离子方程式为_____________。
(2)火法炼锌得到的氧化锌中含有铅、铜等杂质,提纯步骤如下:
![]()
![]()
①上图中的“冷凝物”为________(填化学式)。
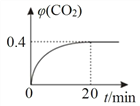
②某温度时,在反应Ⅰ的反应炉中,起始时 c(CO)为 0.3 molL1,反应过程中 CO2 的体积分数 φ(CO2)如图所示,则反应Ⅰ的平衡常数 K=_____。
③下列措施有利于提高反应Ⅰ中 ZnO 转化率的是________。
a.增大 ZnO 的投料量 b.适当加压 c.将锌蒸气及时分离
④反应Ⅱ中,每转移 1mol 电子,反应放热 174 kJ,则 H2=_____________。
(3)测定氧化锌样品纯度:称取 0.5000g 样品,酸溶后定容于 250 mL 容量瓶中,摇匀。量取 25.00 mL 该溶液,用 0.04000 molL1 的 EDTA(Na2H2Y)标准液滴定其中的 Zn2+(反应方程式为 Zn2++H2Y2=ZnY2+2H+,杂质不反应),平行滴定三次,平均消耗 EDTA 标准液 15.12mL。
①若滴定管未用 EDTA 标准液润洗,测定结果将___(填“偏高”、“偏低”或“不变”)。
②样品纯度为:________________(列出计算式即可)。
(4)彩电荧光屏中的蓝色荧光粉含有 ZnS。将含有 0.05mol ZnS 的荧光粉溶于 500mL盐酸中,完全溶解后,溶液中 c(S2)≤__________ molL1。(已知:Ksp(ZnS)=2.5×1023,忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5。向20 mL浓度均为0.1 mol/L NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。下列说法不正确的是

A. a=20,b=40,且溶液呈中性处于A、B两点之间
B. B点溶液中:c(CH3COO-)>c(Na+)>c(NH![]() )
)
C. 已知lg3≈0.5,则C点的pH≈5
D. A、B、C三点中,B点溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究常温下难溶电解质的溶解平衡,查得如下资料:
难溶电解质 | FeS | CuS | Mg(OH)2 | Fe(OH)3 |
Ksp(溶解平衡常数) | 6.3×10-18 | 6.3×10-36 | 1.8×10-11 | 4.0×10-38 |
依据上述数据进行的预测不合理的是
A.向饱和FeS溶液中加入少量Na2S固体,有浑浊出现
B.除去FeSO4溶液中的CuSO4,可选用FeS做沉淀剂
C.向含等物质的量的MgCl2和FeCl3的混合溶液中逐滴加入NaOH溶液,最先出现的沉淀是Mg(OH)2
D.向1mL 0.1 mol·L—1MgCl2溶液中滴加2mL0.1mol·L—1 NaOH溶液,取澄清溶液滴加2滴0.1mol·L—1 FeCl3溶液,有浑浊出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度下CuS的溶度积常数为4.0×10-36,现将0.1 mol CuSO4放入100 mL 1.0 mol·L-1Na2S溶液中,充分搅拌反应(不考虑溶液体积变化),则下列说法不正确的是( )
A.反应后溶液的pH比反应前溶液的pH小
B.反应后溶液中不存在Cu2+、S2-
C.反应后溶液中c(Cu2+)与c(S2-)都约为2.0×10-16mol·L-1
D.若向饱和CuS水溶液中加入Na2S溶液,Ksp(CuS)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com