
下列各组溶液,只用试管和胶头滴管,不用任何试剂不可以鉴别的是
A. CaCl2和Na2CO3 B. 稀H2SO4和Na2CO3
C. KOH和Al2(SO4)3 D. HCl NaAlO2
A
【解析】
试题分析:A.均为无色溶液,改变滴定顺序,均生成碳酸钙白色沉淀,不能鉴别,故A错误;B.将碳酸钠溶液滴加到稀硫酸中立即有气泡生成,将稀硫酸滴加到碳酸钠溶液中,先没有气体生成,当稀硫酸滴加到一定程度后后气体生成,反应现象不同,可以鉴别,故B正确;C.KOH溶液逐滴滴加到Al2(SO4)3溶液中,先生成沉淀,氢氧化钠过量时沉淀溶解,而Al2(SO4)3溶液逐滴滴加到KOH溶液中先没有显现,滴加一定时间后可生成沉淀,现象不同,进而鉴别,故C正确;D.NaAlO2加入到盐酸液,先无沉淀生成,后生成沉淀,但把盐酸液滴加到NaAlO2先有沉淀生成,然后溶解,滴加顺序不同,现象不同,用其他试剂就可以区别,故D正确.故选A.
考点:物质的检验鉴别


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源:2014-2015学年广东省广州市高三1月模拟考试理综化学试卷(解析版) 题型:选择题
如图所示的电化学装置,下列叙述正确的是
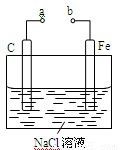
A.a和b用导线连接,电子由碳经过导线流向铁
B.a和b用导线连接,铁电极的电极反应为:Fe-3e-=Fe3+
C.a、b分别连接直流电源正、负极,可以防止铁被腐蚀
D.a、b分别连接直流电源负、正极,电压足够大时,Na+向铁电极移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市四校高一上学期期中联考化学试卷(解析版) 题型:选择题
下列实验操作中不正确的是
A. 用规格为10mL的量筒量取6.2mL的液体
B. 用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液完全蒸干
C. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
D. 制取蒸馏水时,冷凝管中冷凝水应由下口进,上口出
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一上学期期中化学试卷(解析版) 题型:选择题
在含有Fe3+、Fe2+、Al3+、NH4+的溶液中,加入足量Na2O2固体,微热充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有变化的是
A.Al3+ B.Fe3+ C.NH4+ D.Fe2+
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一上学期期中化学试卷(解析版) 题型:选择题
下列各组离子中,在强碱性溶液中能共存,且在加入盐酸过程中会产生气体和沉淀的是
A. Na+、NO3-、AlO2-、SO42- B. Na+、Al3+、NO3-、SO42-
C. Na+、Mg2+、Cl-、HCO3- D. K+、Cl-、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省吉林市高一上学期期末考试化学试卷(解析版) 题型:计算题
(9分)将Mg 、Al组成的混合物共0.1mol溶于100mL 3mol/LHCl溶液中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V的变化如图所示:
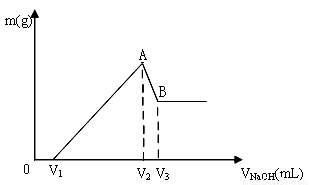
(1)A点沉淀的成分是 (用化学式表示)。
(2)A点沉淀的总物质的量n= 。
(3)V2= 。
(4)若混合物仍为0.1mol,其中Mg的物质的量分数为a,用100mL 3mol/LHCl溶液溶解此混合物后,再加入360mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,则满足此条件的a的取值范围为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省吉林市高一上学期期末考试化学试卷(解析版) 题型:选择题
设阿伏加德罗常数(NA)的数值为nA,下列说法中正确的是
A.1 mol Cl2与足量NaOH反应,转移的电子数为2nA
B.1 mo1Na被完全氧化生成Na2O2,失去的电子数为2nA
C.常温常压下,22.4LSO2气体中含有的原子数小于3nA
D.0.1 mol/LNaOH溶液中含有Na+的数目为0. 1 nA
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省吉林市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列基本反应类型中,一定有电子转移的是
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三1月月考理综化学试卷(解析版) 题型:选择题
稀土是工业味精,邓小平同志说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
A.电解熔融CeO2制Ce,铈在阳极获得
B.铈有四种稳定的核素 Ce、
Ce、 Ce、
Ce、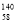 Ce、
Ce、 Ce,它们互为同素异形体
Ce,它们互为同素异形体
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+
D.由于氧化性:Ce4+>Fe3+,而I—有强还原性,所以铈溶于氢碘酸的化学方程式可表示为:2Ce+8HI=2CeI4+4H2↑。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com