
| A. | 金属元素仅存在于矿物中 | |
| B. | 金属元素存在于矿物和动物体內,但植物体內不含 | |
| C. | 少数金属元素以游离态存在,大多数金属元素以化合态存在 | |
| D. | 金属元素仅存在矿物中,动物和植物体內也不存在金属元素 |
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子得失电子能力与该原子最外层电子数多少有关 | |
| B. | ⅠA族、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 | |
| C. | ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱 | |
| D. | 前三周期元素中共有非金属元素12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅制备单晶硅不涉及氧化还原反应 | |
| B. | 硅胶常用做实验时和袋装食品、瓶装药品的干燥剂 | |
| C. | 纯净的硅可做光导纤维的原料 | |
| D. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含H+的溶液 | |
| B. | pH<7的溶液 | |
| C. | c(OH-)<c(H+)的溶液 | |
| D. | 25℃时,由水电离出来的c(H+)=1×10-9mol/L的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol铁与足量的氯气完全反应转移的电子数为2NA | |
| B. | 常温常压下,11.2L氯化氢气体中含有的分子数为0.5NA | |
| C. | 标准状况下,1molCO2、CO的混合气中含有的碳原子数为NA | |
| D. | 1L1mol•L-1CuCl2溶液中含有的氯离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
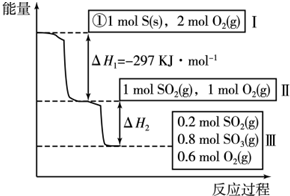 硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol SO2、1mol O2 | 2mol SO3 | 4mol SO2、2mol O2、 |
| 平衡时n(SO3) | 1.6mol | n2 | n3 |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| SO2或SO3的转化率 | α1 | α2 | α3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com