
 Fe3+的转化时,②中的Fe3+作氧化剂.
Fe3+的转化时,②中的Fe3+作氧化剂. 分析 (1)②中Fe元素的化合价降低;
(2)使食物中的Fe3+还原成Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高;
(3)铁粉在人体胃酸的作用下转化成亚铁盐,还生成氢气.
解答 解:(1)②中Fe元素的化合价降低,则,②中的Fe3+作氧化剂,故答案为:氧化;
(2)使食物中的Fe3+还原成Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高,所以维生素C作还原剂,具有还原性,故答案为:还原;还原;
(3)铁粉在人体胃酸的作用下转化成亚铁盐,还生成氢气,该离子反应为Fe+2H+═Fe2++H2↑,故答案为:Fe+2H+═Fe2++H2↑.
点评 本题考查氧化还原反应,题目涉及铁单质及其化合物饿性质,明确反应中元素的化合价变化是解答的关键,侧重基本概念的考查,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
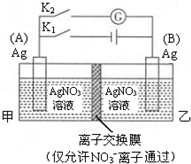
| A. | 闭合K1,断开K2后,A电极增重 | |
| B. | 闭合K1,断开K2后,乙池溶液中Ag+浓度增大 | |
| C. | 断开K1,闭合K2后,B电极发生氧化反应 | |
| D. | 断开K1,闭合K2后,NO3-向A电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电器起火,立即用水扑灭 | |
| B. | 炒菜时油锅着火,立即盖上锅盖 | |
| C. | 厨房煤气管道漏气,立即关闭阀门并开窗通风 | |
| D. | 图书管内图书着火,立即用液态二氧化碳灭火器扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 大理石和醋酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 向Ba(OH)2溶液中滴加KHSO4溶液至中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2 C03溶液呈碱性:C032-+2H20?H2C03+20H- | |
| B. | NaHC03溶液中加过量Ca(OH)2溶液:Ca2++20H-+2HC03-═CaC03++C032-+2H2O | |
| C. | 漂白粉溶液中通入足量二氧化硫气体:ClO-+SO2+H2O═HC1O+HSO3- | |
| D. | 向NaAl02溶液中通入过量C02:AlO2-+CO2+2H2O═Al(OH)3+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| C. | 金属铝排在金属活动性顺序表中氢元素的前面,铝与强酸反应一定放出氢气 | |
| D. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中不一定有铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
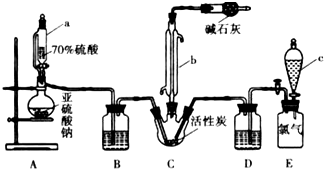 硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:
硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y |
| A | Al | NaOH溶液 |
| B | NO2 | H2O |
| C | Na2O2 | CO2 |
| D | Cu | 浓HNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com