
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不能满足图示转化关系的是

甲 | 乙 | 丙 | 戊 | |
A | Cu | FeCl3溶液 | CuCl2溶液 | Fe |
B | H2O | Fe | H2 | O2 |
C | Al | NaOH溶液 | H2 | Al2O3 |
D | CH3CH2OH | O2 | CH3CHO | H2 |
A. A B. B C. C D. D
【答案】C
【解析】
根据反应甲+乙→丙+丁、丙+戊→甲分析,结合物质的性质采用代入法判断这两个反应是否能发生,如果能发生,则正确,否则错误。
铜和氯化铁反应方程式为:2FeCl3+Cu=CuCl2+2FeCl2,铁和氯化铜反应方程式为:Fe+CuCl2=FeCl2+Cu,所以能实现物质间的转化,A正确;铁和水蒸气反应方程式为4Fe+2H2O(g)![]() Fe3O4+2H2,氢气和氧气反应方程式为2H2+O2
Fe3O4+2H2,氢气和氧气反应方程式为2H2+O2 ![]() 2H2O,所以能实现转化,B正确;Al和氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝不能用氢气还原氧化铝来冶炼,工业上采用电解熔融氧化铝的方法冶炼铝,C错误;乙醇和氧气反应生成乙醛和水,反应方程式为2CH3CH3OH+O22CH3CHO+2H2O,乙醛和氢气发生加成反应生成乙醇,反应方程式为:CH3CHO+H2
2H2O,所以能实现转化,B正确;Al和氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝不能用氢气还原氧化铝来冶炼,工业上采用电解熔融氧化铝的方法冶炼铝,C错误;乙醇和氧气反应生成乙醛和水,反应方程式为2CH3CH3OH+O22CH3CHO+2H2O,乙醛和氢气发生加成反应生成乙醇,反应方程式为:CH3CHO+H2 ![]() CH3CH2OH,氢气在氧气中燃烧生成水,所以能实现转化,D正确。
CH3CH2OH,氢气在氧气中燃烧生成水,所以能实现转化,D正确。
故选C。


科目:高中化学 来源: 题型:
【题目】SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。

(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
①若A为CO,B为H2,C为CH3OH,则通入CO的一极为________极。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为________________________________________________________________________。
③若A为NO2,B为O2,C为HNO3,则正极的电极反应式为________________________________________________________________________。
(2)碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650 ℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接作燃料,其工作原理如图所示。
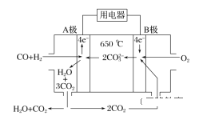
①电池总反应为________________________________________________________________________。
②以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6 g,则阳极产生气体标准状况下体积为______ L。电解后溶液体积为2 L,溶液的pH约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌、消炎作用的黄酮醋酸类化合物L的合成路线如下图所示:
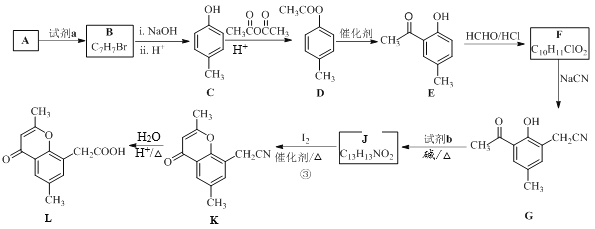
已知部分有机化合物转化的反应式如下:

![]()
![]()
(1)A的分子式是C7H8,其结构简式是______;A→B所属的反应类型为______。
(2)试剂a是__________________________。
(3)C→D的化学方程式是__________________________________________。
(4)F的结构简式是__________;试剂b是___________。
(5)H与I2反应生成J和HI的化学方程式是__________________________。
(6)以A和乙烯为起始原料,结合题中信息,选用必要的无机试剂合成苯乙酸乙酯(![]() ),参照下列模板写出相应的合成路线______________________。
),参照下列模板写出相应的合成路线______________________。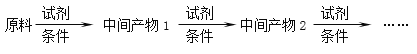
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝原子与氯气反应时失去3个电子,钠原子与氯气反应时失去1个电子,由此得出的下列结论中不正确的是( )
A.铝的活泼性比钠的活泼性强
B.不能说明铝和钠活泼性的强弱
C.在生成的氯化物中钠元素为+1价
D.在生成的氯化物中铝元素为+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中含镁元素的反应物作还原剂的是( )
A.MgCO3=MgO+CO2↑
B.Mg(OH)2+2H+=Mg2++2H2O
C.Mg+2HCl=MgCl2+H2↑
D.Mg2++2OH-=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于食物的酸碱性的说法正确的是
A.食物中的主要成分能与酸反应的是碱性食物
B.食物中的主要成分能与碱反应的是酸性食物
C.食物在遇到甲基橙变红的是酸性食物,遇到酚酞变红的是碱性食物
D.食物的酸碱性应当看食物在体内代谢完全后剩余物质的酸碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用。其工作流程如下:
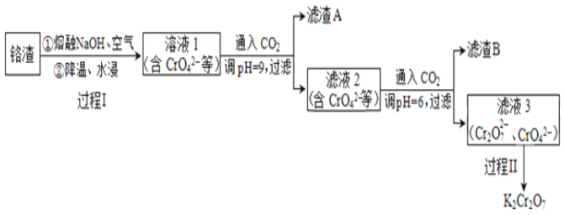
(1)铝热法冶炼金属铬,是利用了金属铝的______(填“氧化性”或“还原性”)。
(2)溶液1中的主要的阴离子有CrO42-、_____(填离子符号)。
(3)过程I,在Cr2O3参与的反应中,若生成0.4 molCrO42-,消耗氧化剂的物质的量是_______。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是_______。
②滤渣B受热分解所得物质可以循环利用,B是________(填化学式)。
③已知:2CrO42-+2H+![]() Cr2O72-+H2O K=4.0×1014
Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04 mol/L,则CrO42-的浓度是_____mol/L。
(5)过程II的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7。
不同温度下化合物的溶解度(g/100gH2O)
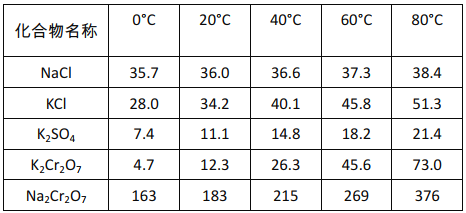
结合表中数据分析,过程II得到K2Cr2O7粗品的操作是:______,过滤得到K2Cr2O7粗品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应第_______分钟到达平衡状态 。
(2)该反应的化学方程式为____________ 。
(3)2 min时,Y的浓度为___________。
(4)反应开始至2 min,气体X的平均反应速率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂不仅是营养物质和主要食物,也是一种重要的工业原料。下面是以油脂为主要原料获得部分产品的合成路线:
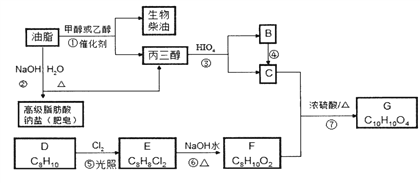
己知:①G (C10H10O4)分子中的官能团处于对位;
②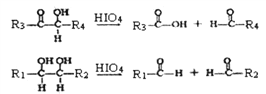
(R1、R2、R3与R4可能是氢、烃基或其他基团)
回答下列问题:
(1)下列关于油脂的说法正确的是____。(填标号)
a.油脂包括植物油和脂肪,属于酯类
b.天然油脂是混合甘油酯组成的混合物,无固定的熔点和沸点
c.油脂属天然高分子化合物,许多油脂兼有烯烃的化学性质
d.硬化油又叫人造脂肪,便于储存和运输,但容易被空气氧化变质
(2)G中官能团的名称为______,反应①的反应类型为_________。
(3)用系统命名法写出F的名称___________。
(4)在酸催化下物质的量的B与苯酚反应生成一种线型结构高分子的化学方程式为______________________。
(5)二元取代芳香化合物H是G的同分异构体,H满足下列条件:
①能发生银镜反应
②酸性条件下水解产物物质的量之比为2:1
③不与NaHCO3溶液反应。
则符合上述条件的H共有______种(不考虑立体结构,不包含G本身)。其中核磁共振氢谱为五组峰的结构简式为________(写出一种即可)。
(6)写出从HOCH2CH2OH![]() HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)______________。
HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com