
【题目】一定温度下,向某恒容密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是
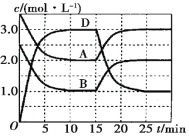
A. 反应在前10min内的平均反应速率v(D)=0.15mol·L-1·min-1
B. 该反应的平衡常数表达式为K= ![]()
C. 若平衡时保持温度不变,压缩容器容积,则平衡向逆反应方向移动
D. 反应至15min时,改变的条件是降低温度
【答案】D
【解析】
A.由图象可知,10min时到达平衡,平衡时D的浓度变化量为3mol/L,故v(D)= ![]() =
=![]() =0.3molL-1min-1,故A错误;B.由图可知,平衡时A、D的浓度变化量分别为1.5mol/L、3mol/L,故1:x=1.5mol/L:3mol/L,所以x=2,C为固体,可逆反应A(g)+B(g)C(s)+xD(g)的平衡常数表达式K=
=0.3molL-1min-1,故A错误;B.由图可知,平衡时A、D的浓度变化量分别为1.5mol/L、3mol/L,故1:x=1.5mol/L:3mol/L,所以x=2,C为固体,可逆反应A(g)+B(g)C(s)+xD(g)的平衡常数表达式K=![]() ,故B错误;C.由图可知,平衡时A、D的浓度变化量分别为1.5mol/L、3mol/L,故1:x=1.5mol/L:3mol/L,所以x=2,反应前后气体的体积不变,增大压强平衡不移动,故C错误;D.由图可知,改变条件瞬间,反应混合物的浓度不变,平衡向逆反应移动,该反应正反应为吸热反应,故改变的条件应是降低温度,故D正确;故选D。
,故B错误;C.由图可知,平衡时A、D的浓度变化量分别为1.5mol/L、3mol/L,故1:x=1.5mol/L:3mol/L,所以x=2,反应前后气体的体积不变,增大压强平衡不移动,故C错误;D.由图可知,改变条件瞬间,反应混合物的浓度不变,平衡向逆反应移动,该反应正反应为吸热反应,故改变的条件应是降低温度,故D正确;故选D。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段.如图是硫元素的常见化合价与部分物质类别的对应关系:
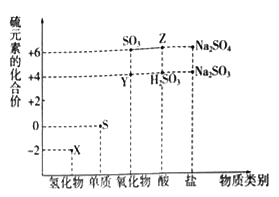
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式).
(2)将X与Y混合,可生成淡黄色固体.该反应中氧化剂与还原剂的物质的量之比为_______.
(3)检验物质Y的方法是_______________________________.
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______.
(5)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号).
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr207氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的溶液恰好反应时,Cr元素在还原产物中的化合价为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
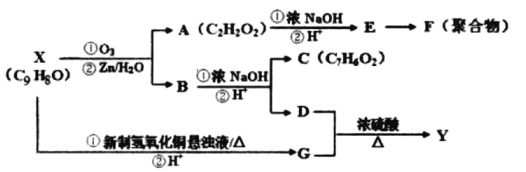
【题目】芳香族化合物X和Y都是从樟脑科植物中提取的香料。X可按如图路线合成Y。
已知:①RCH-CHR’![]() RCHO+R’CHO
RCHO+R’CHO
②不含α-氢原子(与醛基直接相连的碳上的氢)的醛在浓碱作用下醛分子自身同时发生氧化与还原反应,生成相应的羧酸(在碱溶液中生成羧酸盐)和醇的反应。
如:2HCHO![]() HCOOH+CH3OH
HCOOH+CH3OH
(1)X的官能团名称为___________。
(2)Y的结构简式为___________。
(3)D+G→Y的有机反应类型为___________。
(4)下列物质不能与D反应的是___________(选填序号)
a.金属钠 b.氢溴酸 c.碳酸钠溶液 d.乙酸
(5)写出下列反应方程式:X→G的第①步反应_____________________________。E→F___________________________________。
(6)G有多种同分异构体,写出同时满足下列条件的G的所有同分异构体的结构简式______________(不考虑空间立体异构)。
i.能发生银镜反应 ⅱ.能发生水解反应 ⅲ.苯环上只有一个取代基
(7)G的另一种同分异构体H的结构简式为![]() 下,写出以
下,写出以![]() 为有机原料,制取H的合成路线(可任选无机原料)
为有机原料,制取H的合成路线(可任选无机原料) ![]() →___________。
→___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() ;
;
② 苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯作原料制备一系列化合物的转化关系图:

(1)A转化为B的化学方程式是_________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________,②____________________。
(3)苯的二氯代物有__________种同分异构体。
(4)有机物 的所有原子_______(填“是”或“不是”)在同一平面上。
的所有原子_______(填“是”或“不是”)在同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO 合成甲醇的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是

A. 温度:T1>T2>T3 B. 正反应速率:v(a)>v(c),v(b)>v(d)
C. 平衡常数:K(a)>K(c)>K(b)>K(d) D. 平均摩尔质量:M(a)>M(c),M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G7种物质的转化关系如下:
(1)A+B→C+H2O (2)C+KOH→D↓(蓝色)+E
(3) B+D→C+H2O (4)E+BaCl2→KCl + F↓(白色,不溶于稀硝酸)
(5)G+B→CO2↑+F↓+H2O,反应中B与CO2的物质的量之比为1:2
根据上述变化关系填空:
(1)请写出下列物质的化学式:B___;C___;F___;G___。
(2)检验E中的阴离子的实验是___。
(3)往G的溶液中滴加过量的KOH,反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 用氨水吸收少量SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B. 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
C. FeO和稀HNO3的反应:FeO+2H+=Fe2++H2O
D. 碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,美国正在研究的锌电池可能取代目前广泛使用的铅酸蓄电池。锌电池具有容量大、污染少等优点。电池反应为2Zn+O2=2ZnO,原料为锌粒、电解液和空气。下列叙述正确的是( )
A. 锌为正极,空气进入负极反应B. 负极反应为Zn+2OH--2e-=ZnO+H2O
C. 正极发生氧化反应D. 电解液可以是乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。
(1)利用海水可以提取溴和镁,提取过程如下:
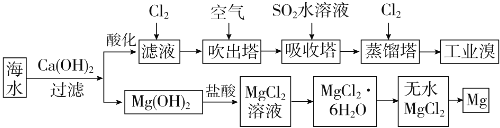
①提取溴的过程中,经过2次Br- → Br2转化的目的是_____,吸收塔中发生反应的离子方程式是________,
②从MgCl2溶液中得到MgCl2.6H2O晶体的主要操作是__________、_________、过滤、洗涤、干燥。
(2)![]()
①灼烧过程中用到的实验仪器有铁三角架、酒精灯、坩埚钳、_____、______。
②操作①中需用到玻璃棒,则玻璃棒的作用是_______________。
③向酸化后的水溶液加入适量3% H2O2溶液,发生反应的化学方程式为________。
④操作③是分液,则操作②是___________;操作④是___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com