
分析 (1)n(CH4)=$\frac{16g}{16g/mol}$=1mol,可知1mol甲烷完全燃烧放出热量为890.0kJ,以此书写热化学方程式;
(2)P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2983.2kJ•mol-1①
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H2=-738.5kJ•mol-1②
由盖斯定律可知,①-②×4得P4(s,白磷)=4P(s,红磷),结合能量越低越稳定来解答.
解答 解:(1)n(CH4)=$\frac{16g}{16g/mol}$=1mol,可知1mol甲烷完全燃烧放出热量为890.0kJ,则热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ/mol;
(2)P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2983.2kJ•mol-1①
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H2=-738.5kJ•mol-1②
由盖斯定律可知,①-②×4得P4(s,白磷)=4P(s,红磷)△H=(-2983.2kJ•mol-1)-(-738.5kJ•mol-1)×4=-29.2kJ/mol,可知白磷转化为红磷放出热量,则红磷能量低,红磷稳定,即白磷的稳定性比红磷低,
故答案为:红磷;低.
点评 本题考查反应热与焓变,为高频考点,把握热化学反应方程式的书写、盖斯定律应用为解答的关键,侧重分析与应用能力的考查,注意稳定性与能量的关系,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
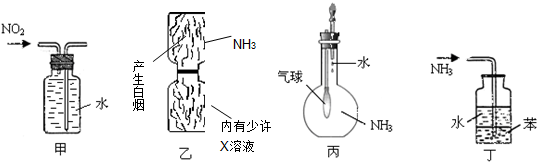
| A. | 图甲:收集NO2气体 | B. | 图乙:验证X溶液为浓硫酸 | ||
| C. | 图丙:验证氨气在水中的溶解性 | D. | 图丁:用于吸收尾气NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的 ①CH3COOK ②KHCO3 ③KClO三种溶液的c(K+):①>②>③ | |
| B. | 0.1mol/L NaHC2O4溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(C2O42-)>c(HC2O4- )>c(OH-)>c(H+) | |
| C. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)═c(H+)+c(HS-)+c(H2S) | |
| D. | 向0.2 mol•L-1的氨水中加入少量氯化铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
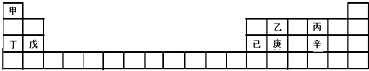
| A. | 甲、丁、戊的单质都是金属 | |
| B. | 乙、丙、辛都是非金属元素 | |
| C. | 乙、庚、辛都能形成氧化物 | |
| D. | 已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
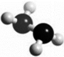 肼(N2H4)是火箭燃料,常温下为液体,其分子的球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.下列说法正确的是( )
肼(N2H4)是火箭燃料,常温下为液体,其分子的球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.下列说法正确的是( )| A. | 标准状况下,11.2L N2H4中含共用电子对数为2.5NA | |
| B. | 1mol N2H4和1mol H2O2含有的电子总数不相等 | |
| C. | 若生成3.6g H2O,则上述反应转移电子的数目为0.2 NA | |
| D. | N2H4和H2O2均只含有极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶液导电的一定是分子晶体 | B. | 熔融态导电的一定是离子晶体 | ||
| C. | 原子晶体固态一定不导电 | D. | 分子晶体熔融态一定不导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com