
| A. | 乙醇能发生氧化反应而乙酸不能发生氧化反应 | |
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 乙醇和乙酸能发生酯化反应,酯化反应和酯的水解反应互为逆反应 |
分析 A、乙醇可被常见的氧化剂如氧气、氧化铜氧化,能发生氧化反应,乙酸也能被氧气氧化成二氧化碳和水;
B、乙酸和乙醇中均含有氢键;
C、乙醇和乙酸是生活中的调味品;
D、酯化反应与水解互为可逆反应.
解答 解:A、乙醇可发生氧化反应,乙酸也能发生氧化反应,故A错误;
B、由于乙酸和乙醇相对分子质量均大于C2H6、C2H4,且分子中均存在氢键,故熔沸点均高于C2H6、C2H4,故B正确;
C、乙醇即为酒的主要成分,可以作为调味品,食醋的主要成分为乙酸,故乙酸也可以作为调味品,故C正确;
D、酯化反应与酯类在酸性条件下的水机为可逆反应,故D正确,故选A.
点评 本题主要考查的是乙醇与乙酸的性质,难度不大,掌握酯类水解在酸性条件下与酯化反应为可逆反应是解决本题的关键.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
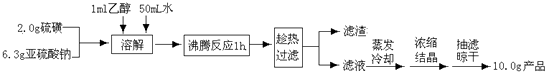
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
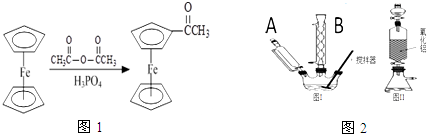
 ),可以使用的仪器分析方法是质谱法(或核磁共振氢谱).(写一种即可)
),可以使用的仪器分析方法是质谱法(或核磁共振氢谱).(写一种即可)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
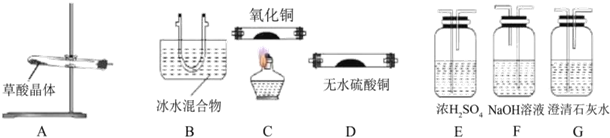
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| B | 其他条件不变,压缩2HI(g)?I2(g)+H2(g)平衡体系的体积 | 混合气体颜色变深 | 平衡向生成I2(g)的方向移动 |
| C | 将碱式滴定管下部的胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠 | 使溶液从尖嘴流出 | 排出碱式滴定管尖嘴部分的气泡 |
| D | 向2.0mL浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1-2滴0.01mol•L-1AgNO3溶液,振荡 | 沉淀呈黄色 | KSP(AgCl)>KSP(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
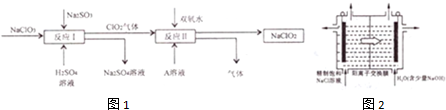
 HClO2+OH-(用离子方程式表示).
HClO2+OH-(用离子方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
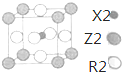 X、Y、Z、W、R是原子序数依次增大的前四周期元素(稀有气体除外).X的基态原子中的电子平均分布在三个不同的能级中;Y的族序数是其周期数的三倍;Z的基态原子核外无未成对电子;W为前四周期中电负性最小的元素;元素R位于周期表的第10列.
X、Y、Z、W、R是原子序数依次增大的前四周期元素(稀有气体除外).X的基态原子中的电子平均分布在三个不同的能级中;Y的族序数是其周期数的三倍;Z的基态原子核外无未成对电子;W为前四周期中电负性最小的元素;元素R位于周期表的第10列.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | Fe2O3溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-═H2O+NH3↑ | |
| D. | 二氧化硫通入溴水中,溴水褪色:SO2+Br2+2H2O═4H++2Br-+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘氨酸 | B. | 丙氨酸 | C. | 苯丙氨酸 | D. | 葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com