
请运用原电池原理设计实验,验证Cu2+、Fe3+氧化性的强弱。请写出电极反应式,负极________________________________________________________________________,
正极________________________________________________________________________,
并在方框内画出实验装置图,要求用烧杯和盐桥,并标出外电路电子流向。
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )
A.W2-、X+ B.X+、Y3+
C.Y3+、Z2- D.X+、Z2-
查看答案和解析>>
科目:高中化学 来源: 题型:
将含有杂质的4.0 g的NaOH固体配成1000 mL溶液,取20 mL溶液置于锥形瓶中,用0.1 mol·L-1盐酸滴定(甲基橙作指示剂),消耗盐酸20.4 mL,则该NaOH固体中含有的杂质可能是( )
A.Na2O B.Na2CO3
C.NaHCO3 D.KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_________________。
(2)用该方法获得的Na2S2O3·H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
【提出假设】 假设1:晶体中只含Na2CO3杂质
假设2:晶体中只含Na2S杂质
假设3:________________________________________________________________________。
【查阅资料】 Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O。
【判断与思考】 某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?________(填“合理”或“不合理”)并说明理由:_________________________________________。
【设计方案进行实验】 基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂:3 mol·L-1H2SO4、1 mol·L-1NaOH、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
| 实验方案 | 现象及结论 |
(3)已知:2Na2S2O3+I2===2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010 mol·L-1的碘水进行多次取样滴定,测得Na2S2O3·5H2O的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝-空气海水电池:以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。
电池总反应为4Al+3O2+6H2O===4Al(OH)3
负极:________________________________________________________________________;
正极:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+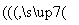 2Pb2++2H2O
2Pb2++2H2O
下列有关新型液流式铅酸蓄电池的说法不正确的是( )
A.放电时,蓄电池由化学能转化为电能
B.充放电时,溶液的导电能力变化不大
C.放电时的负极反应式为Pb-2e-===Pb2+
D.充电时的阳极反应式为Pb2++4OH-+2e-===PbO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离
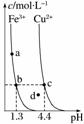
子浓度的变化如图所示。据图分析,下列判断错误的是( )
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com