
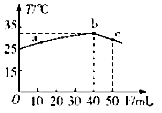
 25℃时,向盛有50mLpH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示,下列叙述正确的是( )
25℃时,向盛有50mLpH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示,下列叙述正确的是( )| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | c点表示酸碱恰好完全反应 | |
| C. | 25℃时,HA的电离平衡常数Ka约为1.43×10-3 | |
| D. | 等浓度的NaOH和NaA 混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>(H+) |
分析 A.当酸碱中和恰好完全时,溶液中的溶质为NaA,根据物料守恒c(A-)与c(HA)之和始终等于钠离子浓度,若酸过量或碱过量时不再相等;
B.恰好中和时混合溶液温度最高,结合图象曲线变化判断;
C.电离平衡常数K=$\frac{c({H}^{+})c({A}^{-})}{c(HA)}$计算得到判断;
D.根据物料守恒,等浓度的NaOH和NaA混合溶液中c(Na+)>c(OH-)>c(A-)>c(H+).
解答 解:A.当酸碱中和恰好完全时,溶液中的溶质为NaA,根据物料守恒c(A-)+c(HA)=c(Na+),若酸过量或碱过量时不再相等,故A错误;
B.恰好中和时混合溶液温度最高,根据图象可知b点温度最高,则b点酸碱恰好完全反应,故B错误;
C.电离平衡常数K=$\frac{c({H}^{+})c({A}^{-})}{c(HA)}$=$\frac{0.01mol/L×0.01mol/L}{0.08mol/L-0.01mol/L}$=1.43×10-3,故C正确;
D.根据物料守恒,等浓度的NaOH和NaA混合溶液中c(Na+)>c(OH-)>c(A-)>c(H+),故D错误.
故选C.
点评 本题考查酸碱混合的定性判断和计算,题目结合中和反应考查了同学们观察分析问题的能力,以及利用化学方程式计算的能力,比较综合.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | ′ | R |
| W |
| A. | 原子半径大小关系为:R>Y>X | |
| B. | X有多种同素异形体,而Y不存在同素异形体 | |
| C. | 根据元素周期律t可以推测W元素的单质具有半导体特性,W2Y3具有氧化性和还原性 | |
| D. | 氢化物熔沸点:H2R>H2Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +H2C=CH2$\stackrel{一定条件}{→}$
+H2C=CH2$\stackrel{一定条件}{→}$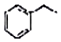
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$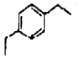
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$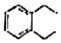
 .
.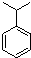 ,N:
,N: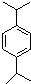 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
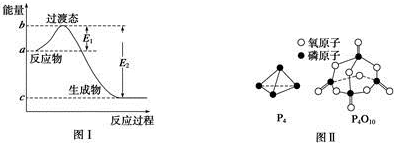
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com