
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
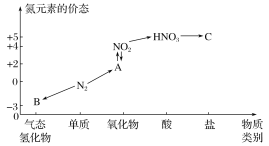
(1)写出N2的两种用途:_________、____。常用作制冷剂的化合物是________(名称)。该物质在空气中与HCl相遇有白烟现象,产生该现象的化学反应方程式是_________。
(2)HNO3与图中的物质C常用于检验Cl-的存在,则C的化学式为_______。
(3)NO2与水反应生成物质A的离子方程式为______________。
(4)浓硝酸与木炭在加热条件下反应的化学方程式为___________________。
(5)氨水显碱性,写出氨水的电离方程式______________________________;
(6)氨催化氧化生成NO是工业制硝酸的反应之一,写出该反应的化学方程式:_______。
【答案】做保护气、 保存粮食、制氨气等 氨气 NH3+HCl=NH4Cl AgNO3 3NO2 +H2O=2H++2NO3- +NO C+4HNO3(浓)![]() CO2+4NO2 +2H2O NH3·H2ONH4++OH- 4NH3+5O2
CO2+4NO2 +2H2O NH3·H2ONH4++OH- 4NH3+5O2 4NO+6H2O
4NO+6H2O
【解析】
B为-3价氮元素的气态氢化物,B为NH3;A为+2价氮元素的氧化物,与NO2相互转化,A为NO;C为某种硝酸盐。
(1)氮气不活泼且性质较稳定,所以可作保护气,能保存粮食,可以制备氨气等;氨气常用作制冷剂;氨气与HCl气体在空气中相遇生成氯化铵固体产生白烟,方程式为NH3+HCl=NH4Cl;
(2)检验氯离子常用硝酸酸化的硝酸银溶液,则C为AgNO3;
(3)NO2与水发生歧化反应,离子方程式为3NO2 +H2O=2H++2NO3- +NO;
(4)在加热条件下浓硝酸可木炭氧化成二氧化碳,浓硝酸被还原成NO2,方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑ +2H2O;
CO2↑+4NO2↑ +2H2O;
(5)一水合氨为弱电解质,在水溶液中部分电离,电离方程式为NH3·H2ONH4++OH-;
(6)氨催化氧化生成NO,反应中氧气做氧化剂,结合电子守恒和元素守恒可知方程式为:4NH3+5O2 4NO+6H2O。
4NO+6H2O。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 2×10-5 |
HClO | HClO | 3.0×10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.61×10-11 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是__(填化学式)。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为__。
(3)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是_。
A.c(H+) B.c(H+)c(CH3COO-) C.c(H+)c(OH-) D.![]()
(4)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1__V2(填“>”、“<”或“=”)。
(5)下列四种离子结合H+能力最强的是__。
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(6)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是___
A.Va>10Vb B.Va<10Vb C.Vb<10Va D.Vb>10Va
(7)25℃时,0.1mol/L CH3COOH溶液的pH约为3,向其中加入CH3COONa晶体,待晶体溶解后发现溶液的pH增大。可能的原因有:①__;②__;为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L CH3COOH溶液中加入少量下列物质中的__(选填字母编号),然后测定溶液的pH。
a.CH3COOK固体 b.CH3COONH4固体 c.NH3 d.NaHCO3固体
(8)已知100℃时,水的离子积常数Kw=1.0×10-12,pH=3的CH3COOH和pH=9的NaOH溶液等体积混合,混合溶液呈__性;
(9)等浓度的①(NH4)2SO4、②NH4HSO4、③NH4HCO3、④NH4Cl、⑤NH3H2O溶液中,NH4+浓度由大到小的顺序是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青花瓷,俗称青花,是中国瓷器的主流品种之一。某同学利用如下方法来粗略测定青花瓷瓶的容积,把![]() NaCl晶体放入到500mL烧杯中,加入200mL蒸馏水,待NaCl完全溶解后,将溶液
NaCl晶体放入到500mL烧杯中,加入200mL蒸馏水,待NaCl完全溶解后,将溶液![]() 包括洗涤液
包括洗涤液![]() 全部转移到该瓶中,用蒸馏水稀释至完全充满容器。从中取出100mL溶液,该溶液恰好能与10mL
全部转移到该瓶中,用蒸馏水稀释至完全充满容器。从中取出100mL溶液,该溶液恰好能与10mL![]() 的
的![]() 溶液完全反应。则下列说法正确的是( )
溶液完全反应。则下列说法正确的是( )
A.该青花瓷瓶的容积约为![]()
B.常温下,该青花瓷瓶几乎能容纳56kg![]()
C.常温常压下,该青花瓷瓶能容纳70g![]()
D.标准状况下,充满HCl气体,加满水后所得溶液物质的量浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1994年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图,呈V型,两个O----O键的夹角为116.5o。三个原子以一个O原子为中心,另外两个O原子分别构成一个共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键——三个O原子均等地享有这个电子。请回答:

(1)臭氧与氧气的关系是_____________。
(2)写出下列分子与O3分子的结构最相似的是_______________。
A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(3)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有________对孤对电子。
(4)O3分子是否为极性分子____________(填是或否)。
(5)O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
_____PbS +___O3=________PbSO4+_______O2
生成1mol O2的转移电子物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g)![]() SO2Cl2(l) ΔH= -97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法错误的是
SO2Cl2(l) ΔH= -97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法错误的是
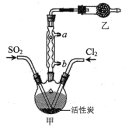
A.乙装置中盛放的试剂是P2O5,防止水蒸气进入装置中
B.装置甲应置于冰水浴中,目的是提高SO2Cl2产率
C.反应结束后,分离甲中混合物的实验操作是蒸馏
D.SO2、Cl2均可使品红试液褪色,原理不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子二次电池正极铝钴膜主要含有LiCoO2、A1等,处理该废料的一种工艺如下图所示,下列说法正确的是
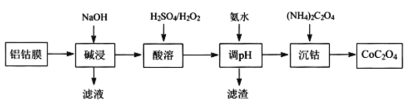
A.酸溶时H2O2做氧化剂,且温度不宜过高
B.加氨水调pH的目的是除铝
C.沉钴的离子方程式为:Co2++C2O42-=CoC2O4↓
D.在空气中加热4.41gCoC2O4得到钴的氧化物2.41g,则该氧化物的化学式为Co3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R为元素周期表中的电负性最强的元素。则下列判断正确的是( )
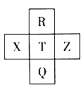
A.非金属性:Z<T<X
B.R与Q的电子数相差24
C.气态氢化物的沸点:R<T<Q
D.最高价氧化物的水化物的酸性:T>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 K 是某药物的中间体,合成路线如图所示:
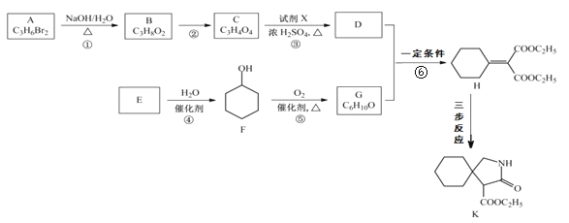
已知:i.R-CN![]() R-CH2-NH2
R-CH2-NH2
ii.R1-NH2+R2COOC2H5![]()
![]() +C2H5OH
+C2H5OH
回答下列问题
(1)A 的名称是_______。
(2)反应①的化学方程式是_____。
(3)反应②的类型是_____。
(4)反应③中的试剂 X是_____。
(5)E 属于烃,其结构简式是_____。
(6)H 中所含的官能团是_____。
(7)反应⑥的化学方程式是_____。
(8)H 经三步反应合成 K:H![]() I→J→K,写出中间产物 I和J的结构简式_____。
I→J→K,写出中间产物 I和J的结构简式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示法正确的是
A.由C(石墨)→C(金刚石);ΔH=+1.9 kJ/mol可知,金刚石比石墨稳定
B.已知:![]() ;ΔH=-92.4 kJ/mol。在一密闭容器中充入2 mol N2、6 mol H2一定条件下充分反应,则反应放出的热量为<184.8 kJ
;ΔH=-92.4 kJ/mol。在一密闭容器中充入2 mol N2、6 mol H2一定条件下充分反应,则反应放出的热量为<184.8 kJ
C.在稀溶液中:![]() ;ΔH=-57.3 kJ/mol,若将含1 mol 醋酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
;ΔH=-57.3 kJ/mol,若将含1 mol 醋酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,H2燃烧的热化学方程式表示为:![]() ;ΔH=+285.8 kJ/mol
;ΔH=+285.8 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com