
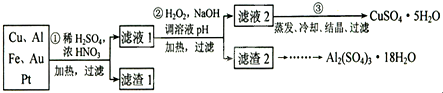
分析 (1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,铜被硝酸氧化成铜离子,硝酸被还原成氮的氧化物,所以滤渣1 的成分是Pt和Au;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染;可以氧化亚铁离子为铁离子易于沉淀除去,调节溶液PH目的是铁离子和铝离子全部沉淀;第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染.调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;
(4)依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
(5)根据离子方程式,Cu2+的物质的量等于EDTA的物质的量,所以由EDTA的物质的量可求出CuSO4•5H2O的物质的量,因为配制了100mL CuSO4溶液,每次取20.00mL实验,所以再乘以5,可得样品中CuSO4•5H2O的物质的量,进而求出CuSO4•5H2O的含量;
a、未干燥锥形瓶,为正确操作,不影响结构;
b、滴定终点时滴定管尖嘴中产生气泡,使标准液的体积测量值变小,结果偏小;
c、未除净可与EDTA反应的干扰离子,增加了EDTA的用量,使结果偏高
解答 解:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,Cu与酸反应的离子方程式为Cu+4H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$3Cu2++2NO↑+4H2O,Au、Pt和酸不反应,所以滤渣是Au、Pt;
故答案为:Cu+4H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$3Cu2++2NO↑+4H2O;Au、Pt;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+;2Fe2++H2O2+2H+=2Fe3++2H2O,过氧化氢做氧化剂被还原后为水,不引入杂质,对环境无污染;调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,
故答案为:将Fe2+氧化为Fe3+;不引入杂质,对环境无污染;Fe3+、Al3+;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水,
故答案为:在坩埚中加热脱水;
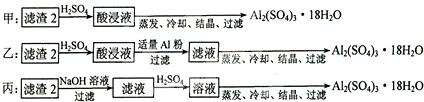
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;
乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙最合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费,
所以上述三种方案中:甲方案制得的硫酸铝晶体中混有大量硫酸铁杂质,不可行;从原子利用率和是否产生杂质考虑知,乙方案更合理,
故答案为:甲、丙;甲所得产品中含有较多Fe2(SO4)3杂质,丙中含有硫酸钠杂质;乙;
(5)根据离子方程式,Cu2+的物质的量等于EDTA的物质的量,所以CuSO4•5H2O的物质的量为bc×10-3 mol,因为配制了100mL CuSO4溶液,每次取20.00mL实验,所以再乘以5,所以样品中CuSO4•5H2O的物质的量为5bc×10-3 mol,则CuSO4•5H2O质量分数为$\frac{5bc×10{\;}^{-3}×250}{a}$×100%;
a、未干燥锥形瓶,为正确操作,不影响结构;
b、滴定终点时滴定管尖嘴中产生气泡,使标准液的体积测量值变小,结果偏小;
c、未除净可与EDTA反应的干扰离子,增加了EDTA的用量,使结果偏高,故选c,
故答案为:$\frac{5bc×10{\;}^{-3}×250}{a}$×100%;c.
点评 本题考查制备硫酸铜和硫酸铝晶体的实验设计,明确离子的性质是解答本题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 50.0 | 342 |
| 硫酸钾 | 0.5 | 174 |
| 阿司匹林 | 0.4 | 180 |
| 高锰酸钾 | 0.5 | 158 |
| 硝酸银 | 0.2 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参与反应的过氧化钠中含阴离子2 mol | |
| B. | 参与反应的二氧化碳的体积为22.4 L | |
| C. | 反应中电子转移的数目为NA个 | |
| D. | 将生成的碳酸钠溶解在1L水中,能得到1mol/L的碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
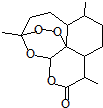 2015年10月5日诺贝尔医学奖授予中国女药学家屠呦呦及美国科学家威廉•坎贝尔和日本大村智,以表彰他们在寄生虫疾病治疗方面取得的成就.屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )
2015年10月5日诺贝尔医学奖授予中国女药学家屠呦呦及美国科学家威廉•坎贝尔和日本大村智,以表彰他们在寄生虫疾病治疗方面取得的成就.屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素的分子式为C15H22O5 | B. | 青蒿素是芳香族化合物 | ||
| C. | 青蒿素可以发生水解反应 | D. | 青蒿素不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C具有还原性 | |
| B. | 上述过程中砷元素发生还原反应 | |
| C. | 上述过程中+5价砷类物质作氧化剂 | |
| D. | 上述过程中+3价砷类化合物是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
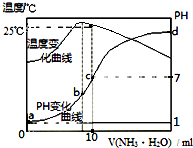
| A. | a点KW=1.0×10-14 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 25℃时,一水合氨的电离平衡常数为$\frac{1{0}^{-7}}{(10n-1)}$(用n表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
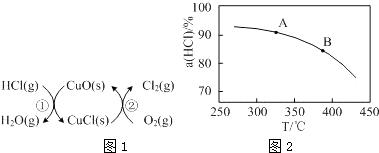
| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10?3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水、氯化铁溶液 | B. | 溴水、酸性高锰酸钾溶液 | ||
| C. | 溴水、碳酸钠溶液 | D. | 氯化铁溶液、酸性高锰酸钾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com