
能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有助于“开源节流”的是________(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气,以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,注重资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
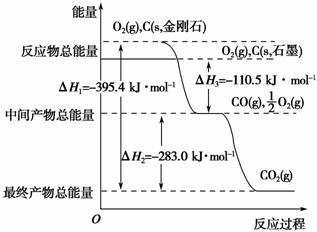
①在通常状况下,金刚石和石墨相比较,________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为________。
②12 g石墨在一定量的空气中燃烧,生成气体36 g,该过程放出的热量为________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ·mol-1
NO分子中化学键的键能为________ kJ·mol-1。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:________________________________________________________________
_____________________________________________________________。
解析 (1)开源节流的主要措施是减少化石燃料的使用、提高燃料的燃烧效率、开发新能源等。(2)①由图知,石墨具有的能量比金刚石的低,而物质所具有的能量越低越稳定,故石墨更稳定。计算标准燃烧热时,要求燃烧产物位于稳定状态,即C应生成CO2气体,故石墨的燃烧热为110.5 kJ·mol-1+283.0 kJ·mol-1=393.5 kJ·mol-1。②12 g石墨在一定量的空气中燃烧,生成气体
36 g,此气体应为CO和CO2的混合气体。设生成CO的物质的量为x,则CO2的物质的量为(1 mol-x),故有28 g·mol-1×x+44 g·mol-1×(1 mol-x)=36 g,解得x=0.5 mol。因此该过程放出的热量为110.5 kJ·mol-1×0.5 mol+393.5 kJ·mol-1×0.5 mol=252.0 kJ。
(3)ΔH=+180.0 kJ·mol-1=946 kJ·mol-1+497 kJ·mol-1-2E(N—O),则E(N—O)=631.5 kJ·mol-1。(4)由图得CO(g)+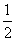 O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1,此式乘以2再与N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ·mol-1相减即得2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.0 kJ·mol-1。
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1,此式乘以2再与N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ·mol-1相减即得2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.0 kJ·mol-1。
答案 (1)acd (2)①石墨 393.5 kJ·mol-1 ②252.0 kJ
(3)631.5 (4)2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.0 kJ·mol-1


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
某有机化合物A的结构简式如下:
(1)A的分子式是__________________。
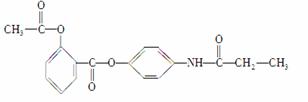
(2)A在NaOH水溶液中充分加热后,再加入过量的盐酸酸化后,可得到B、C、D和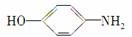 四种有机物,且相对分子质量大小关系为B>C>D。则B、C、D的结构简式分别是:B____________________;C________________;D__________________。
四种有机物,且相对分子质量大小关系为B>C>D。则B、C、D的结构简式分别是:B____________________;C________________;D__________________。
(3)下列物质中,不能与B发生化学反应的是(填序号)________。
①浓H2SO4和浓HNO3的混合液 ②CH3CH2OH(酸催化) ③CH3CH2CH2CH3 ④Na ⑤浓溴水
(4)在B的同分异构体中,属于1,3,5三取代苯的化合物的结构简式为
________________________________________________________________________。
(5)写出B与碳酸氢钠反应的化学方程式:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,将1 mol A和1 mol B气体充入2 L密闭容器,发生反应:A(g)+B(g)xC(g)+D(s) ΔH>0,t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确的是 ( )。

A.t1~t3间该反应的平衡常数均为4
B.反应方程式中的x=1
C.t2时刻改变的条件是使用催化剂
D.t3时刻改变的条件是移去少量物质D
查看答案和解析>>
科目:高中化学 来源: 题型:
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是 ( )。
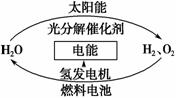
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.2 mol H2O具有的总能量低于2 mol H2和1 mol O2的能量
D.氢气不易贮存和运输,无开发利用价值
查看答案和解析>>
科目:高中化学 来源: 题型:
已知 H2SO4(aq)与 Ba (OH)2(aq)反应的 ΔH=-1 584.2 kJ·mol-1;HCl (aq) 与NaOH (aq) 反应的 ΔH=-55.6 kJ·mol-1。则生成 BaSO4 (s) 的反应热等于 ( )。
A.-1 528.6 kJ·mol-1 B.-1 473 kJ·mol-1
C.+1 473 kJ·mol-1 D.+1 528.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
实验发现,298 K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是 ( )。
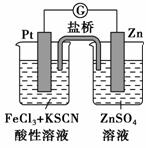
A.该原电池的正极反应是Zn-2e-===Zn2+
B.左烧杯中溶液的血红色逐渐褪去
C.该电池铂电极上有气泡出现
D.该电池总反应为3Zn+2Fe3+===2Fe+3Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
为节省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4 溶液、直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),通过巧妙的构思,设计了比较铜、锌金属活动性相对强弱的系列实验。试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),向烧杯中小心加入稀硫酸,观察到的现象是
________________________________________________________________。
甲同学的设计思路是______________________________________________。
(2)乙同学接着甲的实验,向烧杯中滴加________溶液,进而观察到的现象是______________________________________________________________。
乙同学作出锌、铜金属活动性相对强弱的结论所依据的原理是________________________________________________________________________。
(3)丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了必要的试剂________溶液(作为电解液)。反应在调控下随即开始,实验中有关反应的化学方程式为______________________________________。
实验中的明显现象是______________________________________________。
(4)请你再单独设计一个简单的实验(试剂、仪器自选),探究和证实锌、铜金属活动性的相对强弱(简要说明操作和现象)___________________________________________________________
_______________________________________________________________
_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法错误的是
A.一定条件下,2molSO2和1molO2混合在密闭容器中
充分反应后容器中的分子数大于2NA
B.256g S8分子中含S-S键为7NA个
C.由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个
D.1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
某高聚物可表示为
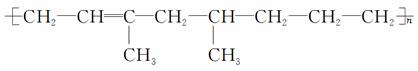
下列有关叙述错误的是( )
A.该高聚物是通过加聚反应生成的
B.合成该高聚物的单体有3种
C.该物质能被酸性KMnO4溶液氧化
D.1 mol该物质与1 mol H2加成,生成不含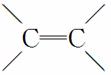 的物质
的物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com