
甲醛在酸性催化剂存在下三分子聚合可以生成性质相对稳定、毒性小、易于运输的三聚甲醛,反应如图所示.下列说法正确的是()

A. 甲醛水溶液可作为食物防腐剂
B. 该反应类型为缩聚反应
C. 三聚甲醛分子中既含σ键又含п键
D. 常温下,9g三聚甲醛中含1.806×1023个碳原子
考点: 有机物的结构和性质.
分析: A.甲醛具有防腐性但有毒;
B.该反应属于加成反应;
C.共价单键只含σ键,共价双键和三键含有σ键、π键;
D.常温下,9g三聚甲醛物质的量=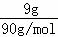 =0.1mol,每个三聚甲醛分子中含有3个碳原子,所以0.1mol三聚甲醛中含有0.3mol碳原子.
=0.1mol,每个三聚甲醛分子中含有3个碳原子,所以0.1mol三聚甲醛中含有0.3mol碳原子.
解答: 解:A.甲醛具有防腐性但有毒,所以不能作食物防腐剂,但能用于动物标本制作,故A错误;
B.该反应符合加成反应特点,所以属于加成反应,故B错误;
C.共价单键只含σ键,共价双键和三键含有σ键、π键,根据结构简式知,三聚甲醛中只含σ键、不含π键,故C错误;
D.常温下,9g三聚甲醛物质的量=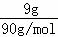 =0.1mol,每个三聚甲醛分子中含有3个碳原子,所以0.1mol三聚甲醛中含有0.3mol碳原子,所以9g三聚甲醛中含1.806×1023个碳原子,故D正确;
=0.1mol,每个三聚甲醛分子中含有3个碳原子,所以0.1mol三聚甲醛中含有0.3mol碳原子,所以9g三聚甲醛中含1.806×1023个碳原子,故D正确;
故选D.
点评: 本题考查有机物结构和性质、物质的量计算及基本概念,明确物质结构及其性质关系是解本题关键,注意:甲醛生成三聚甲醛中断键和成键方式,题目难度不大.


科目:高中化学 来源: 题型:
将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为b g•cm﹣3,则盐酸的物质的量浓度是()
A. 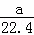 mol•L﹣1 B.
mol•L﹣1 B. 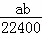 mol•L﹣1
mol•L﹣1
C. 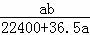 mol•L﹣1 D.
mol•L﹣1 D. 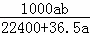 mol•L﹣1
mol•L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈.发生的反应体系中共有六种物质:NH4C1、FeC13、N2、Fe2O3、Fe 和X.
(1)根据题意,可判断出X是 (写化学式).
(2)写出并配平该反应的化学方程式:
(3)发生氧化反应的物质是 ,反应中4mol的氧化剂能 (填“失去”或“得到”) mol电子.
(4)反应中被氧化产生了11.2L(标准状况)的气体时,被还原的物质的质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
一种新型燃料电池,它是用两根金属做电极插入KOH溶液中,然后向两极上分别通甲烷和氧气,下列关于此燃料电池的有关说法中错误的是()
A. 通过甲烷的电极X为电池的负极,通过氧气的电极Y为电池正极
B. 放电一段时间后,电解质溶液中KOH的物质的量改变
C. 在标准状况下,通过5.6L氧气,完全反应后有1.0mol的电子发生转移
D. 放电时,通过甲烷的一极附近的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
如表为元素周期表中的一部分.用化学式或元素符号回答下列问题:
IA ⅡA ⅢA IVA VA ⅥA VⅡA 0
2 ⑥ ⑦
3 ① ③ ⑤ ⑧ ⑩
4 ② ④ ⑨
(1)10种元素中,化学性质最不活泼的是氩(填元素名称).
(2)在①②⑤的最高价氧化物的水化物中,碱性最强的是 (填化学式).
(3)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为
(4)⑧与⑨分别与H2形成的氢化物的稳定性:HCl HBr,(用化学式表示)最高价氧化物对应的水溶液的酸性 .(用化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,甲池的总反应式为N2H4+O2=N2+2H2O,.下列说法正确的是()
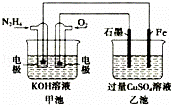
A. 甲池中负极上的电极反应式为N2H4﹣4e﹣=N2+4H+
B. 乙池中石墨电极上发生的反应为4OH﹣﹣4e﹣=2H2O+O2↑
C. 甲池溶液pH增大,乙池溶液pH减小
D. 甲池中每消耗0.1mol N2H4乙池电极上则会析出6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于反应热的说法正确的是()
A. 当△H为“﹣”时,表示该反应为吸热反应
B. 已知C(s)+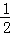 O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
C. 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D. 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上合成氨气,已知通入1mol N2和3mol H2,反应过程中共放出a kJ的热量.经测定反应中N2的转化率为20%(已知:N2的转化率=实际反应的N2的量/初始充入N2的总量),则合成氨气的热化学方程式可表示为()
A. N2(g)+3H2(g)⇌2NH3 (g)△H=a kJ/mol
B. N2(g)+3H2(g)⇌2NH3 (g)△H=﹣a kJ/mol
C. N2(g)+3H2(g)⇌2NH3 (g)△H=5a kJ/mol
D. N2(g)+3H2(g)⇌2NH3(g)△H=﹣5a kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于平衡常数K的说法中,正确的是()
A. 在任何条件下,化学平衡常数是一个恒定值
B. 改变反应物浓度或生成物浓度都会改变平衡常数K
C. 平衡常数K只与温度有关,与反应浓度、压强无关
D. 从平衡常数K的大小不能推断一个反应进行的程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com