
| A. | 加金属钠,有气体产生的是乙醇 | |
| B. | 加水,互溶的是乙醇 | |
| C. | 点燃,容易燃烧的是乙醇 | |
| D. | 和浓硫酸混合共热至170℃,有乙烯产生的是乙醇 |
科目:高中化学 来源: 题型:解答题
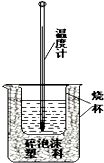 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a和b可形成气态化合物 | |
| B. | c的原子半径小于d的原子半径 | |
| C. | b和c形成的化合物为离子化合物 | |
| D. | a和d最高价氧化物的水化物均呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1的H2SO4溶液 | B. | 0.01mol•L-1的Ba(OH)2溶液 | ||
| C. | c(OH-)=1×10-11mol•L-1的溶液 | D. | c(H+)=1×10-12mol•L-1的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
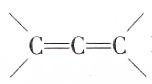 不稳定).
不稳定).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
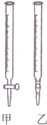 某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.00 | 22.99 |
| 3 | 25.00 | 0.20 | 20.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的HA酸溶液与pH=12的MOH碱溶液以任意比混合:c(OH-)+c(M+)=c(H+)+c(A-) | |
| B. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液和NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO${\;}_{3}^{-}$)-c(CO${\;}_{3}^{2-}$) | |
| C. | 等浓度、等体枳的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水,②10mL0.2mol/LMgCl2,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 用0.1mol•L-1NaOH溶液滴定10mL0.1mol•L-1H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法错误的是( )
用0.1mol•L-1NaOH溶液滴定10mL0.1mol•L-1H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法错误的是( )| A. | A点溶液中加入少量水:$\frac{c(O{H}^{-})}{c({H}_{2}A)}$增大 | |
| B. | B点:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | C点:c(Na+)=c(HA-)+2c(OH-) | |
| D. | 水电离出来得c(OH-):B>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
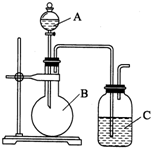 某同学设计如图装置,探究非金属性质变化规律.
某同学设计如图装置,探究非金属性质变化规律.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com