
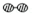
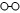
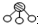
 �ֱ��ʾN2��H2��NH3����
�ֱ��ʾN2��H2��NH3����
 ����֮�ȣ���̼�ȣ�$\frac{n��N{H}_{3}��}{n��C{O}_{2}��}$=x����ͼ��CO2ƽ��ת���ʣ����� �백̼�ȣ�x���Ĺ�ϵ��
����֮�ȣ���̼�ȣ�$\frac{n��N{H}_{3}��}{n��C{O}_{2}��}$=x����ͼ��CO2ƽ��ת���ʣ����� �백̼�ȣ�x���Ĺ�ϵ������ ��1��ͼ���DZ�ʾN2��H2�������ڴ����ı��棬ͼ�ݱ�ʾ���ɵ�NH3�뿪�������棬ͼ�����ʾ�ڴ������棬N2��H2�еĻ�ѧ�����ѣ�
��2���÷�Ӧ����Ԫ�ػ��ϼ���+7�۱�Ϊ+2�ۣ�NԪ�ػ��ϼ���+3�۱�Ϊ+5�ۣ����Ԫ���غ㡢�����ƺ������֮��Ĺ�ϵʽ�������
��3��������ƽ�ⳣ�����¶ȱ仯�����жϷ�Ӧ���ȡ����ȣ�
������Ӧ��Ũ�ȣ�ƽ��������У�����x�����ͼ�����ݷ�����ϻ�ѧ����ʽ���㰱��ת���ʣ�
�۵�x=2��ԭ�����е�NH3��CO2�����ʵ���֮��Ϊ2���������̼���ʵ���Ϊm���������ʵ���Ϊ2m��������Ӧ��5minʱ�����ʵ�Ũ�Ȳ��ٷ����仯����Ӧ�ﵽƽ��״̬�������ϵѹǿ��Ϊ��ʼʱ��$\frac{2}{3}$������ѹǿ֮�ȵ����������ʵ���֮�ȣ���Ӧ��������õ�90g���أ����ʵ���n��CO��NH2��2��=$\frac{90g}{60g/mol}$=1.5mol�����İ������ʵ���Ϊ3mol�����Ķ�����̼���ʵ���Ϊ1.5mol�����û�ѧƽ�����м�����ʽ���㣬
2NH3��g��+CO2��g��?CO��NH2��2��l��+H2O��l����
��ʼ����mol�� 2m m 0 0
�仯����mol�� 3 1.5 1.5 1.5
ƽ������mol�� 2m-3 m-1.5 1.5 1.5
��Ӧ����V=$\frac{��c}{��t}$��
ƽ�ⳣ��K=$\frac{������ƽ��Ũ���ݴη��˻�}{��Ӧ��ƽ��Ũ���ݴη��˻�}$��
c=$\frac{n}{V}$��
��� �⣺��1����������ͼ����֪����ͼ�ڱ�ʾN2��H2�������ڴ������棬��ͼ�۱�ʾ�ڴ������棬N2��H2�л�ѧ�����ѣ�
�ʴ�Ϊ���ڴ�������N2��H2�����еĻ�ѧ�����ѣ�����Nԭ�Ӻ�Hԭ�ӣ�
��2��a���÷�Ӧ��NԪ�ػ��ϼ�+3��Ϊ�������Σ���a����
b������ת�Ƶ����غ�ã�����1molNaNO3������KMnO4�����ʵ���=$\frac{1mol��5-3��}{7-2}$=0.4mol����b��ȷ��
c������Ԫ���غ㡢����غ�֪��K��H+�������Ӳμӷ�Ӧ������Һ��������Ũ�Ƚ��ͣ�����Һ��pH����c����
d������Ԫ���غ㡢����غ�֪�����е�������H+����d����
��ѡb��
��3����ƽ�ⳣ�����¶�����С��˵������ӦΪ���ȷ�Ӧ����H��0���ʴ�Ϊ������
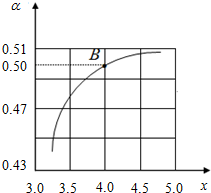
��2NH3 ��g��+CO2 ��g��?CO��NH2��2 ��l��+H2O ��l����ͼ������жϣ�������Ũ��ƽ��������У�������̼ת��������B�㴦x=4��ԭ�����е�NH3��CO2�����ʵ���֮��Ϊ4��������̼ת����Ϊ50%�����谱��Ϊ4mol��������̼Ϊ1mol����Ӧ�Ķ�����̼Ϊ0.5mol��
���ݻ�ѧ����ʽ2NH3��g��+CO2��g��?CO��NH2��2��l��+H2O��l����Ӧ�İ���Ϊ1.0mol��
NH3��ƽ��ת����=$\frac{1.0mol}{4mol}$��100%=25%��
�ʴ�Ϊ��x�����൱��c��NH3������CO2ת��������25%��
�۵�x=2��ԭ�����е�NH3��CO2�����ʵ���֮��Ϊ2���������̼���ʵ���Ϊm���������ʵ���Ϊ2m��������Ӧ��5minʱ�����ʵ�Ũ�Ȳ��ٷ����仯����Ӧ�ﵽƽ��״̬�������ϵѹǿ��Ϊ��ʼʱ��$\frac{2}{3}$������ѹǿ֮�ȵ����������ʵ���֮�ȣ���Ӧ��������õ�90g���أ����ʵ���n��CO��NH2��2��=$\frac{90g}{60g/mol}$=1.5mol�����İ������ʵ���Ϊ3mol�����Ķ�����̼���ʵ���Ϊ1.5mol�����û�ѧƽ�����м�����ʽ���㣬
2NH3��g��+CO2��g��?CO��NH2��2��l��+H2O��l����
��ʼ����mol�� 2m m 0 0
�仯����mol�� 3 1.5 1.5 1.5
ƽ������mol�� 2m-3 m-1.5 1.5 1.5
�����ϵѹǿ��Ϊ��ʼʱ��$\frac{2}{3}$������ѹǿ֮�ȵ����������ʵ���֮�ȣ�2m-3+m-1.5=$\frac{2}{3}$����2m+m��
m=4.5mol
������̼��Ӧ����V=$\frac{��c}{��t}$=$\frac{\frac{1.5mol}{2L}}{5min}$=0.15mol/L•min��
ƽ��ʱ������Ũ��=$\frac{2��4.5mol-3mol}{2L}$=3mol/L��CO2��Ũ��=$\frac{4.5mol-1.5mol}{2L}$=1.5mol/L
ƽ�ⳣ��K=$\frac{1}{{3}^{3}��1.5}$=0.074��
�ﵽƽ���NH3�����ʵ���Ũ��=$\frac{2��4.5mol-3mol}{2L}$=3mol/L��
�ʴ�Ϊ��0.15mol•L-1•min-1��0.074��3 mol•L-1��
���� ���⿼����������ԭ��Ӧ����ѧ��Ӧ���ʡ���ѧƽ��ļ��㡢����ת���ʵ�֪ʶ��Ӧ�ã���Ҫ�Ǹ��������Ӧ�ã���Ŀ�Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe2O3+3CO=�T2Fe+3CO2��H=-28.5 kJ•mol-1 | |
| B�� | Fe2O3��s��+3CO��g���T2Fe��s��+3CO2��g����H=-28.5 kJ | |
| C�� | Fe2O3��s��+3CO��g���T2Fe��s��+3CO2��g����H=+28.5 kJ•mol-1 | |
| D�� | Fe2O3��s��+3CO��g���T2Fe��s��+3CO2��g����H=-28.5 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | PO43- | B�� | CCl4 | C�� | NO3- | D�� | SiH4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol �ǻ���-OH�����еĵ�����Ϊ10 NA | |
| B�� | �����£�0.2 mol Fe������ˮ������Ӧ������H2�ķ�����Ϊ0.3 NA | |
| C�� | 7.8 g Na2S��Na2O2�Ĺ��������к��е���������Ϊ0.1 NA | |
| D�� | �ö��Ե缫��ⱥ��ʳ��ˮ����·��ͨ��NA�����ӣ���������������11.2 L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CaCO3�TCaO+CO2�� | B�� | NaHCO3+NaOH�TNa2CO3+H2O | ||
| C�� | Ca��ClO��2+CO2+H2O�TCaCO3��+2HClO | D�� | 3K2MnO4+2H2O�T2KMnO4+MnO2��+4KOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��KSCN��Һ����FeCl2�Ƿ��ѱ����������� | |
| B�� | ����ɫ��Ӧ����NaCl��KCl | |
| C�� | �ü��ȷ���ȥNa2CO3�л��е�NaHCO3���� | |
| D�� | ��NaOH��Һ��ȥMgCl2��Һ�е�CuCl2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������Ż�ʱ��������ˮ��� | |
| B�� | ����ϡ����ʱ��ˮ����Ũ������ | |
| C�� | �õ�ȼ�Ļ����Һ������ƿ�ڼ����Ƿ�©�� | |
| D�� | ��������й©ʱ��Ѹ���뿪�ֳ����������ߴ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| ���� | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com